短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素.试回答下列问题:
(1)A的元素符号______;D的原子结构示意图.
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是______.
(3)A、B、C、D形成的化合物B2A2、CD2、D2A、DA2中各原子都满足最外层8电子结构的是______(填写具体的化学式 ).
(4)CA2与D元素的单质在水溶液中反应的离子方程式是______.
A原子的最外层电子数是次外层电子数的3倍,则A为O元素;B是短周期元素中原子半径最大的主族元素,则B为Na元素.短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,则C为S元素;B、C、D同周期,则D为Cl元素.
即A为O元素;B为Na元素;C为S元素;D为Cl元素.
(1)A为O氧元素,元素符号为O;D为Cl元素,核内质子数为17,有3个电子层,最外层电子数为7,原子结构示意图为
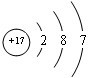
.
故答案为:O;

.
(2)A、B、C元素形成的简单离子分别是O2-、Na+、S2-,Na+、O2-离子的核外电子排布相同,核电荷数越大,离子半径越小,所以离子半径O2->Na+,S2->O2-的最外层电子数相同,电子层越多,离子半径越大,所以离子半径S2->O2-,所以离子半径S2->O2->Na+.
故答案为:S2->O2->Na+.
(3)B2A2、CD2、D2A、DA2分别是Na2O2;SCl2;Cl2O;ClO2,过氧化钠为离子化合物,各原子都满足最外层8电子结构,SCl2;Cl2O;ClO2是共价化合物,最外层电子数+化合价绝对值=8,则满足8电子结构,所以SCl2、Cl2O满足最外层8电子结构.
故答案为:Na2O2;SCl2;Cl2O.
(4)氯气具有强氧化性,在溶液中将二氧化硫氧化为硫酸,反应离子方程式为SO2+Cl2+2H2O═4H++2Cl-+SO42-.
故答案为:SO2+Cl2+2H2O═4H++2Cl-+SO42-.
