(14分)常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL0.1000 mol·L-1CH3COOH溶液,pH的变化如图1所示。
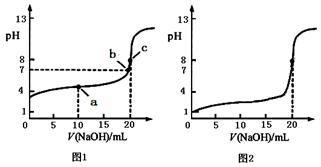
⑴根据图1,用化学符号表示滴定过程中溶液中微粒之间的关系
①点a处: c(CH3COO-)+c(CH3COOH) = 。
②点b处:溶液中离子浓度大小关系: 。
③点c处:c(CH3COOH)+c(H+) = 。
⑵甲同学也用0.1000 mol·L-1NaOH溶液滴定 20.00mL0.1000 mol·L-1CH3COOH溶液进行滴定实验,该同学所绘制的滴定曲线如图2所示。图2中有一处明显错误,请指出错误的原因:
。
⑶乙同学设计了用0.1000 mol·L-1标准盐酸滴定20.00mL未知浓度氨水的中和滴定实验。
①0.1000 mol·L-1标准盐酸应盛放在 (填仪器名称)中。
②为减少实验误差,指示剂应选用: 。
③滴定过程中眼睛始终注视 。
④若实验中锥形瓶用待盛放的未知浓度氨水润洗,则测定结果将 。(选填“偏高”、“偏低”或“不影响”)
⑷实验室配制pH相等的CH3COONa溶液、NaOH溶液和Na2CO3溶液,三种溶液中溶质的物质的量浓度分别为c1、c2、c3,比较c1、c2、c3的大小关系:
< < 。
(14分)
⑴2c(Na+) c(Na+)=c(CH3COO-)>c(OH-)=c(H+) c(OH-)
⑵CH3COOH为弱酸,在水溶液中部分电离,起点pH大于1(每空2分)
⑶酸式滴定管 甲基橙 锥形瓶中溶液颜色的变化 偏高(各1分)
⑷c2<c3<c1 (2分)
题目分析:⑴根据图1,用化学符号表示滴定过程中溶液中微粒之间的关系。
①点a处: c(CH3COO-)+c(CH3COOH) =2c(Na+)。是物料守恒;
②点b处:溶液中离子浓度大小关系:PH=7,c(Na+)=c(CH3COO-)>c(OH-)=c(H+);
③点c处:c(CH3COOH)+c(H+) =c(OH-)。是质子守恒;
⑵甲同学也用0.1000 mol·L-1NaOH溶液滴定 20.00mL0.1000 mol·L-1CH3COOH溶液进行滴定实验,该同学所绘制的滴定曲线如图2所示。图2中有一处明显错误,请指出错误的原因:
CH3COOH为弱酸,在水溶液中部分电离,起点pH大于1。
⑶乙同学设计了用0.1000 mol·L-1标准盐酸滴定20.00mL未知浓度氨水的中和滴定实验。
①0.1000 mol·L-1标准盐酸应盛放在酸式滴定管中。
②为减少实验误差,指示剂应选用:甲基橙。
③滴定过程中眼睛始终注视锥形瓶中溶液颜色的变化。
④若实验中锥形瓶用待盛放的未知浓度氨水润洗,相当于增加了氨水的量,则测定结果将偏高。
⑷实验室配制pH相等的CH3COONa溶液(是强碱弱酸盐,醋酸酸性大于碳酸)、NaOH溶液和Na2CO3溶液(是强碱弱酸盐,醋酸酸性大于碳酸),所以三种溶液中溶质的物质的量浓度分别为c1、c2、c3的大小关系:c2<c3<c1 。
点评:酸碱中和滴定注意事项
一 摇瓶时,应微动腕关节,使溶液向一个方向做圆周运动,但是勿使瓶口接触滴定管,溶液也不得溅出。
二 滴定时左手不能离开旋塞让液体自行流下。
三 注意观察液滴落点周围溶液颜色变化。开始时应边摇边滴,滴定速度可稍快(每秒3~4滴为宜),但是不要形成连续水流。接近终点时应改为加一滴,摇几下,最后,毎加半滴,即摇动锥形瓶,直至溶液出现明显的颜色变化,而且半分钟内不褪色,准确到达终点为止。滴定时不要去看滴定管上方的体积,而不顾滴定反应的进行。加半滴溶液的方法如下:微微转动活塞,使溶液悬挂在出口嘴上,形成半滴(有时还不到半滴),用锥形瓶内壁将其刮落。
四 每次滴定最好从“0.00”ML处开始(或者从0ML附近的某一段开始),这也可以固定使用滴定管的某一段,以减小体积误差。
五 计算时应注意
A、碱式滴定管没有用待测液润湿,结果偏低。
B、酸式滴定管没用标准液润湿,结果偏高。
六 数据处理
为减少实验误差,滴定时,要求重复试验2~3次,求出所用标准溶液体积的平均值,然后在计算待测液的物质的量浓度。
