已知氮元素有许多化合价,其化合价有一3、0、+1、+2、+3、+4、+5
(1)下表是硝酸与某种金属M在某些条件下反应所得还原产物的关系:
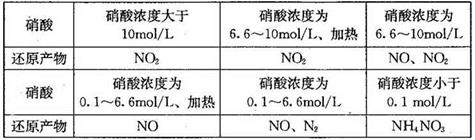
金属锌与某浓度的硝酸反应时,无气体产生,则此化学反应中被还原的硝酸与参加反应的硝酸物质的量之比是____________。
(2)以氨作为燃料的固体氧化物(含有02-)燃料电池,具有全固态结构、能量效率高、无污染等特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体。其工作原理如图所示,
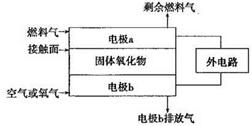
①该电池工作时的总反应为_______________________
②固体氧化物作为电池工作的电解质,O2-移动方向为________(选填“由电极a向电极b”或“由电极b向电极a”)。
③该电池工作时,在接触面上发生的电极反应为________。
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。如图所示装置可用于制备N2O5,写出在电解池中生成N2O5的电极反应式________________。

(1)1:10 4Zn+10HNO3(稀)=4Zn(NO3) 2+NH4NO3+3H2O。(2)4NH3+3O2=2N2+6H2O.由电极b向电极a(因为阴离子向原电池的负极移动) 2NH3+3O2-+6e-= N2+3H2O (3)N2O4+2HNO3-2e-=2N2O5+2H+。
题目分析:(1)金属锌与某浓度的硝酸反应时,无气体产生,说明硝酸被还原产生的氨气被硝酸吸收产生了硝酸铵。反应的化学方程式为:4Zn+10HNO3(稀)=Zn(NO3) 2+NH4NO3+3H2O此化学反应中有10个HNO3参加反应,其中被还原的HNO3是1个。所以被还原的硝酸与参加反应的硝酸物质的量之比是1:10.(2)①该电池工作时的总反应为4NH3+3O2=2N2+6H2O。② 固体氧化物作为电池工作的电解质,O2-会向正电荷较多的负极方向移动。即移动方向为由电极b向电极a。③该电池工作时,在接触面上发生的电极反应为2NH3+3O2-+6e-= N2+3H2O 。(3)用电解法以N2O4和2HNO3为原料,在电解池中生成N2O5的电极反应式N2O4+2HNO3-2e-=2N2O5+2H+。
