镍、钴、铈、铬虽然不是中学阶段常见的金属元素,但在工业生产中有着重要的作用。
(1)二氧化铈 (CeO2)是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,H2O2在该反应中作_____(填“氧化”“还原”)剂,每有1mol H2O2参加反应,转移电子的物质的量为_____。
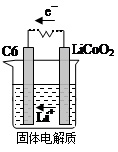
(2)某锂离子电池含Li+导电固体为电解质。充电时,Li+还原为Li,并以原子形式嵌入电极材料碳(C6)中,以LiC6表示,电池反应为LiCoO2+ C6 CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。
CoO2+LiC6。则放电时,电池的正极反应式为________________,如图表示该装置工作时电子和离子的移动方向,此时该电池处于_________(填“放电”或“充电”)状态。
(3)自然界Cr主要以三价Cr和六价Cr的形式存在。六价Cr能引起细胞的突变和癌变。可以用亚硫酸钠将其还原为三价铬,完成并配平下列离子方程式:__Cr2O72-+__SO32-+__H+=__Cr3++__SO42-+ __ ____
(4)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等元素)为原料获得。操作步骤如下:
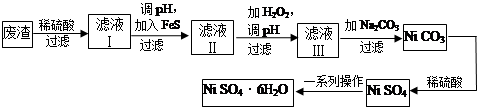
向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,除去Cu2+的离子方程式为______________________。
②向滤液Ⅱ中加入H2O2,溶液中发生反应的离子方程式为__________________,调节pH的目的是______________________。
③滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4的目的是______________________。
④我国第五套人民币中的一元硬币材料为钢芯镀镍,镀镍时,镍应作_____极。
(1)还原(1分);2mol(单位错误或不写单位均扣1分)
(2)CoO2+Li++e-= LiCoO2;充电
(3)Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O
(4)①FeS(s)+Cu2+(aq)=CuS(s)+Fe2+(aq);(没有标明聚集状态不扣分)
②2Fe2++H2O2+2H+=2Fe3++2H2O;
使Fe3+生成氢氧化铁沉淀,以除去Fe3+(只答提纯、除杂或除去杂质不得分)。
③增大NiSO4的浓度,以利于蒸发结晶(关键词为增大浓度,答为提纯或除杂不得分。)
④阳(1分)
题目分析:(1)CeO2转化为Ce3+,Ce化合价降低,CeO2为氧化剂,则H2O2为还原剂;反应时H2O2转化为O2,O元素化合价由—1升高到0,所以每有1mol H2O2参加反应,转移电子的物质的量为2mol。
(2)电池的正极反应为还原反应,根据电池反应可知电极方程式为:CoO2+Li++e-= LiCoO2;根据示意图,电子移向C6电极,C6电极发生得电子反应,即还原反应,充电时C6得电子转化为LiC6,此时该电池处于充电状态。
(3)Cr元素化合价由+6价降低为+3价,S元素由+4价升高为+6价,根据氧化还原反应中化合价升高的价数与化合价降低的价数相等可配平化学方程式,根据元素守恒可知未知生成物为H2O。
(4)①加入FeS后,与Cu2+反应生成更难溶的CuS,所以离子方程式为:FeS(s)+Cu2+(aq)=CuS(s)+Fe2+(aq)
②滤液Ⅱ中含有Fe2+,加入H2O2发生氧化还原反应,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;Fe3+r容易发生水解反应转化为Fe(OH)3沉淀,所以调节pH可以使Fe3+生成氢氧化铁沉淀,以除去Fe3+。
③滤液Ⅲ中NiSO4的浓度较低,加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4,NiSO4浓度变大,利于蒸发结晶。
④电镀时,镀层金属作阳极,所以镀镍时,镍应作阳极。
