水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s)+H2O(g)═CO (g)+H2 (g)△H=+131.3kJ•mol-1
(1)该反应的平衡常数K随温度的升高而______(增大/减小/不变).
(2)上述反应达到平衡后,将体系中的C(s)全部移走,平衡______(向左移/向右移/不移动).
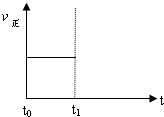
(3)上述反应在t0时刻达到平衡(如图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
①缩小容器体积(用实线表示)
②降低温度(用虚线表示)
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ______ | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正______ν逆 |
(1)该反应正反应是吸热反应,升高温度平衡向正反应方向移动,平衡常数增大;
故答案为:增大;
(2)将C全部移走,由于是可逆反应,还会生成碳,生成的碳不能完全反应,故平衡向左移动,
故答案为:向左移;
(3)①缩小容器体积,压强增大,瞬间正反应速率加快,平衡向逆反应移动,正反应速率增大到新平衡;②降低温度,瞬间正反应速率减慢,平衡逆反应移动,正反应速率增大到新平衡,故图象为:
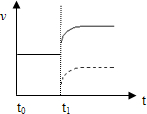
故答案为:

;
(4)由Ⅰ可知,平衡常数k=
=1,Ⅱ中处于平衡状态,根据平衡常数可知Ⅱ中c(H2)=0.1×0.6 0.06
=K•c(H2O) c(CO)
=0.6,1×0.12 0.2
Ⅲ中此时的浓度商Qc=
=0.8<1,故反应向正反应方向进行,故ν正>ν逆,0.4×0.2 0.1
故答案为:0.06;>;
(5)原电池正极发生还原反应,氧气在正极放电,采用质子交换膜,故负极产生的氢离子移向正极,故氧气在正极放电生成水,电极反应式为:O2+4H++4e-=2H2O,该原电池的实质是甲醇燃烧产生二氧化碳与水,故总反应式为:2CH3OH+3O2=2CO2+4H2O,
故答案为:O2+4H++4e-=2H2O;2CH3OH+3O2=2CO2+4H2O.
