现有三个反应:反应
① Fe(s)+H2O(g) FeO(s)+H2(g) △H1 平衡常数为K1
FeO(s)+H2(g) △H1 平衡常数为K1
反应② CO(g)+H2O(g) H2(g)+CO2(g) △H2 平衡常数为K2
H2(g)+CO2(g) △H2 平衡常数为K2
反应③ Fe(s)+CO2(g) FeO(s)+CO(g) △H3 平衡常数为K3
FeO(s)+CO(g) △H3 平衡常数为K3
在不同温度下,部分K1、K2的值如下:

(1)K1的表达式为______;根据反应①、②、③推导出K1、K2、K3的关系式K3=______。
(2)要使反应①在一定条件下建立的平衡右移,可采取的措施有_________。(填字母)
A.缩小容器体积 B.降低温度 C.升高温度 D.使用合适的催化剂
E.设法减少H2的量 F.设法减少FeO的量
(3)800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应②,反应过程中测定的部分数据见下表
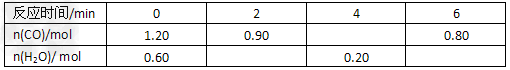
①反应在2 min内的平均速率为v(H2O)=________________;
②800℃时,K2的值为_______________;
③保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率_______(填“增大”或“减小”或“不变”)。
(4)由以上信息推断反应③正反应方向为________(填“放热”或“吸热”)反应。
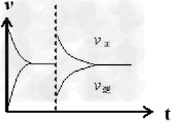
(5)在恒温恒压密闭容器中通入CO和H2O各1 mol发生反应②,当反应达到平衡后,维持温度与压强不变,t1时再通入各1 mol的CO和H2O的混合气体,请在下图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图。

(1)K1 = c(H2) / c(H2O);K1/K2
(2)CE
(3)①0.075 mol·L-1·min-1; ②1;③增大
(4)放热
(5)