氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
(1)传统哈伯法合成氨工艺中相关的反应式为:N2+3H2
2NH3 △H<0.催化剂 △
①该反应的平衡常数K的表达式为:K=______.升高温度,K值______(填“增大”“减小”或“不变”).
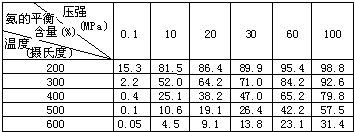
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3).分析表中数据,______(填温度和压强)时H2转化率最高,实际工业生产不选用该条件的主要原因是______.
③下列关于合成氨说法正确是______(填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
D.增大n(N2):n(H2)的比值,有利于提高H2的转化率
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.它既有液氢燃料电池的优点,又克服了液氢不易保存的不足.其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为
4NH3+3O2=2N2+6H2O
你认为电解质溶液应显______ 性(填“酸性”、“中性“、“碱性”),写出负极电极反应式______.
(1)①根据化学方程式可写出平衡常数为k=
,由于反应放热,升高温度平衡向逆反应方向移动,则平衡常数减小,c2(NH3) c(N2)•c3(H2)
故答案为:k=
;减小;c2(NH3) c(N2)•c3(H2)
②200℃、100MPa时氨气的含量最大,则H2转化率最高,但实际工业生产中越强不能太大,因压强太高,对生产设备要求也高,难以实现,
故答案为:200℃、100MPa;压强太高,对生产设备要求也高,难以实现;
③A.催化剂不影响平衡移动,故A错误;
B.寻找常温下的合适催化剂可减少能量的消耗,为研究的主要方向,故B正确;
C.△S<0,需在一定温度下才能进行,故C错误;
D.增大n(N2)可提高H2的转化率,故D正确.
故答案为:BD;
(2)氨气为碱性气体,易与酸反应,所以电解质溶液应呈碱性,负极发生氧化反应,氨气被氧化生产氮气,电极反应式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:碱性;2NH3-6e-+6OH-=N2+6H2O.
