Ⅰ.磷、硫元素的单质和化合物应用广泛。
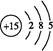
(1)磷元素的原子结构示意图是 。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2 6CaSiO3+P4O10
6CaSiO3+P4O10
10C+P4O10 P4+10CO
P4+10CO
每生成1 mol P4时,就有 mol电子发生转移。
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2 C6H6O6+2H++2I-
C6H6O6+2H++2I-
2S2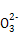 +I2
+I2 S4
S4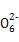 +2I-
+2I-
在一定体积的某维生素C溶液中加入a mol/L I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol/L Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是 mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2I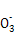 +5S
+5S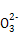 +2H+
+2H+ I2+5S
I2+5S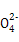 +H2O
+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
| 0.01 mol/LKIO3酸性溶液(含淀粉)的体积/mL | 0.01 mol/LNa2SO3溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
该实验的目的是 ;表中V2= mL。
Ⅱ.稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中,NH4Cl的作用是 。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
Ce3++H2O2+H2O Ce(OH)4↓+ 。
Ce(OH)4↓+ 。
(1)
(2)20
(3)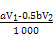 (或其他合理答案)
(或其他合理答案)
(4)探究该反应的速率与温度、亚硫酸钠溶液浓度的关系(或其他合理答案) 40
(5)分解出氯化氢气体,抑制CeCl3水解(或其他合理答案)
(6)2Ce3++1H2O2+6H2O 2Ce(OH)4↓+6H+
2Ce(OH)4↓+6H+
Ⅰ.(1)P的原子序数是15,因此其原子结构示意图为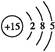 。
。
(2)P元素的化合价由+5价降到了P4中的0价,故每生成1 mol P4转移20 mol电子。
(3)根据化学方程式可知,I2的物质的量等于硫代硫酸钠的物质的量的一半加上维生素C的物质的量,则维生素C的物质的量为:(V1·a×10-3-0.5V2·b×10-3)mol。
(4)通过分析表中的数据可知,该实验研究的是温度、浓度对反应速率的影响;由于实验1和实验2的温度相同,故实验2与实验3的溶液的浓度一定相同,即水的体积一定相同,因此V2=40(mL)。
Ⅱ.(5)由于加热时氯化铵分解放出氯化氢气体,可以抑制CeCl3的
水解。
(6)分析反应可知,Ce3+化合价升高到了Ce(OH)4中的+4价,而H2O2中O的化合价由-1价降到-2价,根据电子守恒可确定Ce3+的化学计量数是2,而H2O2的化学计量数为1,再根据电荷守恒可知缺少的物质是H+,最后根据原子守恒配平反应:2Ce3++1H2O2+6H2O 2Ce(OH)4↓+6H+。
2Ce(OH)4↓+6H+。
