近年来,高锰酸钾在饮用水和工业污水处理领域的消费需求增长较快。实验室可用二氧化锰为主要原料制备高锰酸钾。其部分流程如下:
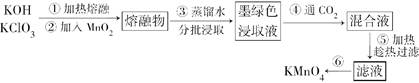
(1)第①步中采用铁坩埚而不用瓷坩埚的原因是(用化学方程式表示)________________________________________。
(2)KOH、KClO3和MnO2共熔反应生成墨绿色K2MnO4的化学方程式为________________________________________。
(3)第④步通入CO2可以使MnO42—发生反应,生成MnO4—和MnO2。则K2MnO4完全反应时,转化为KMnO4的百分率约为________(精确到0.1%)。
(4)第⑤步趁热过滤的目的是______________________________________。
(5)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、________、洗涤、干燥。干燥过程中,温度不宜过高,因为____________________________________。
(1)SiO2+2KOH=K2SiO3+H2O
(2)6KOH+KClO3+3MnO2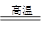 KCl+3K2MnO4+3H2O
KCl+3K2MnO4+3H2O
(3)66.7 %
(4)减少过滤时的损耗(或防止降温过程中KMnO4析出而损耗)
(5)过滤 温度过高KMnO4会分解
流程中先将MnO2转化为K2MnO4,K2MnO4发生自身氧化还原反应生成KMnO4。(1)第①步中采用铁坩埚而不用瓷坩埚是由于后者含有的SiO2在高温下会与KOH发生反应:SiO2+2KOH=K2SiO3+H2O。(2)KOH、KClO3和MnO2共熔时,MnO2被氧化为K2MnO4,KClO3被还原为KCl,化学方程式为6KOH+KClO3+3MnO2 KCl+3K2MnO4+3H2O。(3)第④步通入CO2可以使MnO42—发生反应,根据得失电子守恒可知生成MnO4—和MnO2的物质的量之比为2∶1,则K2MnO4完全反应时,转化为KMnO4的百分率约为66.7 %。(4)第⑤步趁热过滤的目的是防止降温过程中KMnO4析出而损耗。(5)干燥过程中,温度不宜过高,否则KMnO4会分解。
KCl+3K2MnO4+3H2O。(3)第④步通入CO2可以使MnO42—发生反应,根据得失电子守恒可知生成MnO4—和MnO2的物质的量之比为2∶1,则K2MnO4完全反应时,转化为KMnO4的百分率约为66.7 %。(4)第⑤步趁热过滤的目的是防止降温过程中KMnO4析出而损耗。(5)干燥过程中,温度不宜过高,否则KMnO4会分解。
