铜是生物体必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式:________________________________________________________________________________________________________________________________________________。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出溶出铜的离子方程式:________________________________________________________________________________________________________________________________________________。
(3)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,该反应的氧化剂是______________;当生成19.2 g Cu时,反应中转移的电子为__________mol。
6Cu+SO2↑,该反应的氧化剂是______________;当生成19.2 g Cu时,反应中转移的电子为__________mol。
(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜锈的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。试写出上述过程中负极的电极反应式:________________________________________________________________________________________________________________________________________________。
(5)研究性学习小组用“间接碘量法”测定某试样CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取a g试样配成100 mL溶液,每次取25.00 mL,滴加KI溶液后有白色碘化物沉淀生成。写出该反应的离子方程式:___________________________。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为I2+2Na2S2O3=2NaI+Na2S4O6,平均消耗c mol/L的Na2S2O3溶液V mL。则试样中CuSO4·5H2O的质量分数为______________。
(1)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)Cu+H2O2+2H+=Cu2++2H2O
(3)Cu2O和Cu2S 0.3
(4)2Cu+4OH-+CO2-4e-=Cu2(OH)2CO3+H2O
(5)2Cu2++4I-=2CuI↓+I2 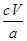 ×100%
×100%
(2)H2O2在酸性条件下能将Cu氧化为Cu2+。(3)该反应中Cu2S和Cu2O中Cu的化合价均由+1价降低为Cu中的0价,Cu2S和Cu2O均为氧化剂,硫元素化合价由-2价升高到+4价,转移电子数为6个,故生成0.3 mol Cu时转移电子为0.3 mol。(4)Cu在负极失去电子形成Cu2+,Cu2+再与空气中的CO2、H2O 结合生成铜锈。(5)根据电子守恒得关系式:Cu2+~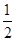 I2~Na2S2O3,故试样中CuSO4·5H2O的质量分数为
I2~Na2S2O3,故试样中CuSO4·5H2O的质量分数为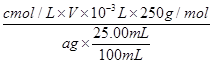 ×100%=
×100%=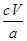 ×100%。
×100%。
