二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)
2SO3(g).某温度下,SO2的平衡转化率与体系总压强(p)的关系如图所示.根据图示回答下列问题:催化剂 △
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.该反应的平衡常数等于______.
②平衡状态由A变到B时,平衡常数K(A)______K(B)(填“>”、“<”或“=”).
(2)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ.
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去.转化流程如图所示:
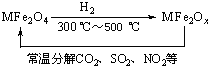
请写出MFe2Ox分解SO2的化学方程式______(不必配平).
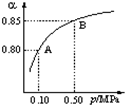
(1)①由图象知,体系总压强为0.10MPa时SO2的平衡转化率为0.8,则
2SO2(g)+O2(g)

2SO3(g)
起始:2.0mol 1.0mol 0
转化:1.6mol 0.8mol 1.6mol
平衡:0.4mol 0.2mol 1.6mol
则平衡时:c(SO2)=0.04mol/L,c(O2)=0.02mol/L,c(SO3)=0.16mol/L,
k=
=c2(SO3) c2(SO2)•c(O2)
=800,0.162 0.042×0.02
故答案为:800;
②平衡常数只受温度的影响,温度不变,则压强不变,平衡状态由A变到B时,则k(A)=k(B),
故答案为:=;
(2)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
利用盖斯定律将
可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ/mol①+② 2
n(CH4)=
=0.2mol,4.48L 22.4L/mol
整个过程中转移的电子总数为:0.20mol×8NA=1.60NA,
放出的热量为:0.2mol×867kJ/mol=173.4kJ,
故答案为:1.60NA(或1.6NA);173.4;
(3)由题意可知,铁酸盐(MFe2O4)经高温还原而得,则反应物中MFe2Ox为还原剂,SO2为氧化剂,生成物为MFe2O4和S,则反应的关系式为MFe2Ox+SO2→MFe2O4+S,
故答案为:MFe2Ox+SO2→MFe2O4+S.
