问题
问答题
常温下用惰性电极电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(以下气体体积已换算成标准状况下的体积),根据图中信息回答下列问题。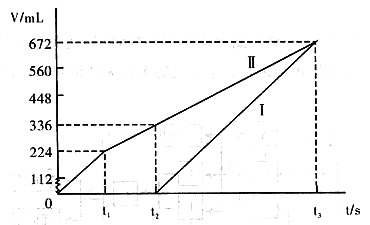
(1)通过计算推测:
①原混合溶液NaCl和CuSO4的物质的量浓度。
②t2时所得溶液的pH。
(2)若用惰性电极电解NaCl和CuSO4的混合溶液200mL,经过一段时间后两极均得到224mL气体,求原混合溶液中的氯离子浓度和铜离子浓度的取值范围。
答案
参考答案:
(1)①阳极首先逸出的是Cl2,n(NaCl)=2n(Cl2)=0.02mol,则c(NaCl)=0.1mol/L
阳极得到336mL气体中,含0.01moICl2和0.005molO2,转移电子的物质的量为:0.01mol×2+0.005mol×4=0.04mol
此过程中阴极刚好全部析出铜n(CuSO4)=n(Cu)=0.04mol÷2=0.02mol,则c(CuSO4)=0.1mol/L
②t2时溶液中c(Na+)=0.1mol/L,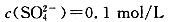
根据电荷守恒有:c(H+)=2×0.1mol/L-0.1mol/L=0.1mol/L,即溶液的pH=1
(2)用极值法计算得0<c(Cl-)<0.1mol/L,0<c(Cu2+)<0.05mol/L。
