问题
选择题
LiAlH4是重要的储氢材料,其组成类似于Na3AlF6。常见的供氢原理如下面两个方程式所示:
①2LiAlH4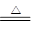 2LiH+2Al+3H2↑
2LiH+2Al+3H2↑
②LiAlH4+2H2O=LiAlO2+4H2↑
下列说法正确的是( )
A.LiAlH4是共价化合物,LiH是离子化合物
B.生成等质量的氢气,反应①、②转移电子数之比为43
C.氢化锂也是一种储氢材料,供氢原理为LiH+H2O=LiOH+H2↑
D.若反应①中生成3.36 L氢气,则一定有2.7 g铝生成
答案
答案:C
A项,LiAlH4由Li+、AlH4—构成,它是离子化合物,错误;B项,反应①中生成3 mol氢气时,转移6 mol电子,反应②中生成4 mol氢气时,转移4 mol电子,生成等量氢气时转移电子数之比为21,错误;C项,氢化锂具有强还原性,与水发生归中反应生成氢气,正确;D项,氢气所处温度和压强不确定,不一定是标准状况,所以无法计算铝的质量,错误。
点拨:本题考查化合物的分类、氧化还原反应原理及简单计算等,意在考查考生将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题的能力。
