问题
选择题
将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2.24 L NO,剩余9.6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是( )
A.原混合物中铜和铁各0.15 mol
B.稀硝酸的物质的量浓度为1 mol/L
C.第一次剩余的9.6 g金属为铜和铁
D.再加入上述200 mL稀硝酸,还能得到标准状况下2.24 L NO
答案
答案:A
因反应后的溶液加入KSCN不变红,说明铁生成了Fe2+,稀硝酸共生成了0.2 mol NO,转移电子总数为0.6 mol。设混合物中Cu为x mol,铁为y mol,则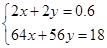 ,解之x=0.15,y=0.15,所以A项正确。无法确定硝酸的总物质的量,B项错误。9.6 g金属失去0.3 mol电子,金属的物质的量为0.5 mol,M=
,解之x=0.15,y=0.15,所以A项正确。无法确定硝酸的总物质的量,B项错误。9.6 g金属失去0.3 mol电子,金属的物质的量为0.5 mol,M=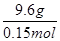 =64 g/mol,剩余金属为铜,C项错误。Fe2+的物质的量为0.15 mol,只能失去0.15 mol电子,所以不能生成2.24 L NO,D项错误。
=64 g/mol,剩余金属为铜,C项错误。Fe2+的物质的量为0.15 mol,只能失去0.15 mol电子,所以不能生成2.24 L NO,D项错误。
