在硫酸工业中,SO2转化为SO3是一个关键步骤.
(1)SO2有氧化性又有还原性,还有漂白性.将SO2氧化通入酸性KMnO4溶液中,溶液褪色,SO2表现______性,其中氧化剂和还原剂物质的量之比为______(已知KMnO4酸性条件下的还原产物为Mn2+).
(2)某温度下,SO2(g)+
O2(g)⇌SO3(g);△H=-98 kJ•mol-1.开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时放出热量196kJ,该温度下平衡常数K=______. 1 2
(3)下列关于2SO2(g)+O2(g)⇌2SO3(g);△H=-196kJ•mol-1反应的如图1图象中,错误的是______.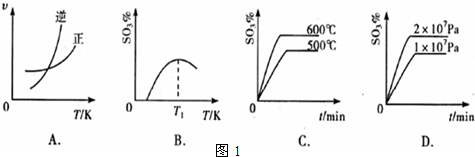
(4)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g)⇌2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是______(填字母).
A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 mol O2
D.保持容器体积不变,升高混合气体温度
E.移动活塞压缩气体
(5)某人设想以如图2装置生产硫酸,写出a电极的电极反应式______.检验SO42-的具体操作为______.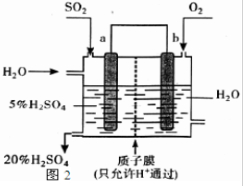
(1)SO2气体通入酸性KMnO4中,酸性KMnO4褪色,高锰酸钾中锰元素是最高价具有氧化性,二氧化硫具有还原性;Mn元素化合价由+7价降低到+2价,化合价变化5价,S元素化合价由+4价升高到+6价,化合价变化2价,氧化还原反应中氧化剂和还原剂得失电子数目相等,则氧化剂和还原剂物质的量之比为2:5,
故答案:还原;2:5;
(2)SO2(g)+
O2(g)⇌SO3(g);△H=-98kJ•mol-1,在100L的密闭容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196kJ,则消耗SO2 2mol,1 2
SO2(g)+
O2(g)⇌SO3(g);△H=-98kJ•mol-1,1 2
起始 4.0mol 10.0mol 0
转化 2.0mol 1.0mol 2mol
平衡 2.0mol 9.0mol 2mol
则平衡时:c(SO2)=0.02mol/L,c(O2)=0.09mol/L,c(SO3)=0.02mol/L,
所以k=
=3.33,0.02 0.02× 0.09
故答案为:3.33;
(3)A.升高温度,逆反应速率增大更多,平衡向逆反应方向移动,图象与实际符合,故A正确;
B.升高温度,平衡向逆反应方向移动,三氧化硫的含量降低,图象与实际符合,故B正确;
C.升高温度,加快反应速率到达平均的时间缩短,逆反应速率增大更多,平衡向逆反应方向移动,三氧化硫的含量降低,图象与实际不符,故C错误;
D.增大压强,加快反应速率到达平均的时间缩短,正反应速率增大更多,平衡向正反应方向移动,三氧化硫的含量增大,图象与实际符合,故D正确;
故答案为:C;
(4)A.保持温度和容器体积不变,充入2mol SO3,平衡向逆反应分析移动,则SO2、O2、SO3气体平衡浓度都比原来增大,故A正确;
B.保持温度和容器体积不变,充入2mol N2,对平衡移动没有影响,各物质的浓度不变,故B错误;
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2,平衡向正反应方向移动,则SO2、O2、SO3气体平衡浓度都比原来增大,故C正确;
D.升高温度,平衡向逆反应分析移动,SO3的浓度减小,故D错误;
E.移动活塞压缩气体,体积减小,各物质的浓度都增大,故E正确.
故答案为:ACE;
(5)依据图装置分析,二氧化硫失电子发生氧化反应,二氧化硫被氧化为三氧化硫溶于水生成硫酸,电极反应为:SO2+2H2O-2e-=SO42-+4H+;检验硫酸根离子的方法为:取少量溶液于试管中加入盐酸,无明显现象,再加入BaCl2溶液,若产生白色沉淀说明溶液中含SO42-,
故答案为:SO2+2H2O-2e-=SO42-+4H+;取少量溶液于试管中加入盐酸,无明显现象,再加入BaCl2溶液.
