A、B、C、D、F是常见的化合物,其中F在常温下是一种无色液体,D为强酸,请根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
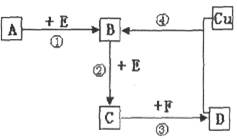
(1)若A、B、C、D均为含硫元素的化合物,A是一种常见的矿石的主要成分,且A的摩尔质量为120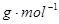 。 反应①的化学方程式为 ;
。 反应①的化学方程式为 ;
(2)若A、B、C、D均为含氮元素的化合物,且A的一个分子中只含有10个电子,则:
①A分子式为__________;
②反应④的离子方程式为________________________________________________
③取Cu和Cu2O的混合物样品12.0g,加入到足量的D的稀溶液中,用排水法收集产生的气体,标准状况下其体积为2.24L,则样品中Cu2O的质量为__________g。
(1)4FeS2+11O2 Fe2O3+8SO2;(2分)
Fe2O3+8SO2;(2分)
(2)①NH3 ;(2分)
②3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;(2分)
③4.32g(2分,4.3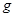 也得分)
也得分)
题目分析:(1)A是一种常见的矿石的主要成分,且A的摩尔质量为120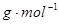 ,A是FeS2,E为氧气,则反应①的化学方程式为4FeS2+11O2
,A是FeS2,E为氧气,则反应①的化学方程式为4FeS2+11O2 Fe2O3+8SO2;
Fe2O3+8SO2;
(2)①A、B、C、D均为含氮元素的化合物,A的一个分子中只含有10个电子,则A是NH3;
②E是氧气,B是NO,C是NO2,F是水,D为硝酸,所以反应④的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
③设Cu和Cu2O的物质的量分别为x、y,根据得失电子守恒,2.24L/22.4L/mol×3=2x+2y,二者的质量为12.0g,所以有64x+144y=12,解得y=0.03mol,因此Cu2O的质量是0.03mol×144g/mol=4.32g

