问题
填空题
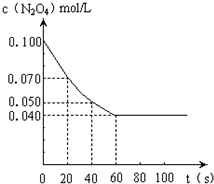
在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4

2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
(1)计算在20至40秒时间内,NO2的平均生成速率为______mol•L-1•S-1.
(2)该反应的化学平衡常数表达式为K=______.
(3)下表是不同温度下测定得到的该反应的化学平衡常数.
| T/K | 323 | 373 |
| K值 | 0.022 | 0.36 |
答案
(1)在20至40秒时间内,c(N2O4)=
=0.001mol/(L•s),0.07mol/L-0.05mol/L 20s
由方程式可知:c(NO2)=2×c(N2O4)=2×0.001mol/(L•s)=0.002mol/(L•s),故答案为:0.002;
(2)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,在N2O4

2NO2中,k=
,C2(NO2) C(N2O4)
故答案为:
;C2(NO2) C(N2O4)
(3)由表中数据可知,温度升高,平衡常数增大,则说明升高温度,平衡向正反应方向移动,则正反应为吸热反应,
故答案为:吸热.
