问题
填空题
建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2
能发生如下反应:
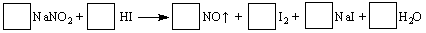
(1)配平上述反应方程式,将系数填入方框中。
(2)上述反应的氧化剂是 ,若反应中有5 mol电子转移,则生成NO在标准状况下的体积是 L。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水;②碘化钾淀粉试纸;③淀粉;④白酒;⑤食醋,进行实验,下列几组合适的是 。
A.③⑤
B.①②④
C.①②⑤
D.①②③⑤
答案
(1)2NaNO2 + 4HI =2NO + I2 +2 NaI +2 H2O (2)NaNO2;112 (3)C
题目分析:(1)根据得失电子守恒法配平方程式,亚硝酸钠中N为+3价,反应后降为+2价;HI中I为-1价,反应后成为单质升高为0价,所以答案为2NaNO2 + 4HI =2NO + I2 +2 NaI +2 H2O;
(2)氧化剂是元素化合价降低的物质,所以氧化剂是NaNO2;每生成1molNO,则转移1mol电子,若反应中有5 mol电子转移,则生成5molNO,标准状况下的体积是112L;
(3)根据(2)可知,亚硝酸钠在酸性条件下,可以氧化碘离子为碘单质,碘遇淀粉变蓝色,所以选择的一组试剂是C。
