过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下:
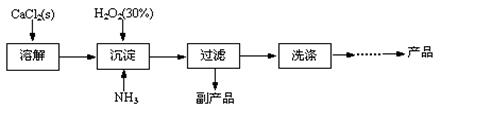
(1)用上述方法制取CaO2·8H2O的化学方程式是 。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
① ;② 。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200mol·L—1 KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为 。
(4)根据表1数据计算产品中CaO2·8H2O的质量分数(写出计算过程):
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
表1. KMnO4标准溶液滴定数据
(1)CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl;(2)①温度低可减少过氧化氢的分解,提高过氧化氢的利用率(或防止过氧化氢的分解);②通入过量的NH3使溶液呈碱性,抑制CaO2·8H2O的溶解(或提高产品的产率);(3)当滴入最后一滴KMnO4标准溶液后由无色变浅红色,且半分钟内不褪色。(4)82.91% 5 CaO2·8H2O ~ 5 H2O ~ 2 KMnO4
n(CaO2·8H2O)=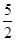 n(KMnO4)=
n(KMnO4)= 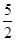 ×0.0200mol/L×23.03mL×10-3L/mL=1.1151×10-3mol,所以CaO2·8H2O的质量分数为:
×0.0200mol/L×23.03mL×10-3L/mL=1.1151×10-3mol,所以CaO2·8H2O的质量分数为: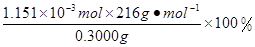 =82.91%
=82.91%
题目分析:(1)根据题意可知:用上述方法制取CaO2·8H2O的化学方程式是CaCl2+H2O2+2NH3+ 8H2O= CaO2·8H2O↓+2NH4Cl。(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3是因为①温度低可减少过氧化氢的分解,提高过氧化氢的利用率;②通入过量的NH3使溶液呈碱性,抑制CaO2·8H2O的溶解(或提高产品的产率)。(3)CaO2+2H2O=Ca(OH)2+H2O2; 2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O.当达到滴定终点时会观察到溶液由无色变为浅红色,半分钟内不褪色。(4)由方程式得关系式为:5CaO2·8H2O ~2KMnO4。消耗的KMnO4溶液的体积为{(24.04-1.02)+( 25.03-2.00)+( 23.24-0.20)}ml÷3=23.03ml.n(CaO2·8H2O)=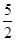 n(KMnO4)=
n(KMnO4)= 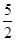 ×0.0200mol/L×23.03mL ×10-3L/mL ="1.1151" ×10-3mol 。所以CaO2·8H2O的质量分数为:
×0.0200mol/L×23.03mL ×10-3L/mL ="1.1151" ×10-3mol 。所以CaO2·8H2O的质量分数为: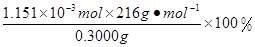 =82.91%。2·8H2O的制备原理及操作注意问题、滴定终点的判断、物质含量的测定的知识。
=82.91%。2·8H2O的制备原理及操作注意问题、滴定终点的判断、物质含量的测定的知识。
