问题
选择题
在V L密闭容器中,通入0.2 mol SO2和0.2 mol SO3气体,在一定条件下,发生可逆反应:
2SO2+O2 2SO3,平衡时SO3为a mol,在相同温度下分别按下列配比在V L密闭容器中放入起始物质,平衡时有关SO3的物质的量叙述正确的是[ ]
2SO3,平衡时SO3为a mol,在相同温度下分别按下列配比在V L密闭容器中放入起始物质,平衡时有关SO3的物质的量叙述正确的是[ ]
A.放入0.3 mol SO2、0.1 mol O2、0.1 mol SO3,达到平衡时SO3必小于a mol
B.放入0.2 mol SO2、0.1 mol O2、0.2 mol SO3,达到平衡时SO3必小于a mol
C.放入0.4 mol SO2、0.1 mol O2,达到平衡时SO3必等于0.4 mol
D.放入0.2 mol SO2、0.1 mol O2,达到平衡时SO3必小于a mol
答案
答案:D

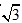 A
A /2
/2 /2A
/2A