(15分)2012年4月15日,央视曝光河北一药用胶囊厂用皮革废料所生产明胶作原料。这些企业用生石灰处理皮革废料进行脱色漂白和清洗,随后熬制成工业明胶,卖给浙江新昌县药用胶囊生产企业,最终流向药品企业,进入消费者腹中。记者调查发现9家药厂的13个批次药品所用胶囊重金属铬含量超标。重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业制备的流程如下: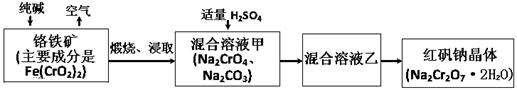
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2为了加快该反应的反应速率,可采取的措施是 。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:2CrO42-+2H+= Cr2O72-+H2O ;
3CrO42-+4H+= Cr3O102-+2H2O ① 往混合溶液甲中加入硫酸必须适量的原因是 。
② 混合溶液乙中溶质的化学式是 。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O  2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
(5)请配平碱性溶液还原法中发生的离子反应:□Cr2O72-+□S2-+□H2O - □Cr(OH)3+□S2O32-+□OH-
(1)FeO·Cr2O3
(2)粉碎矿石、升高温度
(3)① 少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物。② Na2Cr2O7和Na2SO4
(4)c(CrO42-)2c(H+)2/c(Cr2O72-) 正向
(5) 4 6 19 8 3 14
题目分析:(1)Fe(CrO2)2用氧化物的形式可写为FeO·Cr2O3。(2)加快该反应的反应速率的措施有粉碎矿石、升高温度、增大氧气的浓度等。(3)①往混合溶液甲中加入硫酸必须适量的原因是若是少量不能除尽其中的Na2CO3等杂质,若是过量又会生成Na2Cr3O10等副产物。②根据反应方程式2Na2CrO4+H2SO4= Na2Cr2O7+H2O +Na2SO4可知:混合溶液乙中溶质的化学式是Na2Cr2O7和Na2SO4。(4)反应Cr2O72-+H2O  2CrO42-+2H+的化学平衡常数
2CrO42-+2H+的化学平衡常数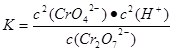 。若继续加水稀释,由于生成物的系数大。所以稀释的倍数多,稀释后生成物的浓度减小的多,平衡正向移动。(5)根据电子守恒、电荷守恒及原子守恒可配平方程式为4Cr2O72-+6S2-+19H2O =8Cr(OH)3+3S2O32-+14OH-。
。若继续加水稀释,由于生成物的系数大。所以稀释的倍数多,稀释后生成物的浓度减小的多,平衡正向移动。(5)根据电子守恒、电荷守恒及原子守恒可配平方程式为4Cr2O72-+6S2-+19H2O =8Cr(OH)3+3S2O32-+14OH-。
