问题
选择题
容器中发生一个化学反应,反应过程中存在H2O、H2S、S、NH4+、H+、NO3—六种物质。在反应过程中测得NO3—和S的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是
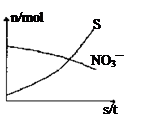
A.配平后氧化剂与还原剂的化学计量数之比为1:4
B.硫元素在反应中被还原
C.还原剂是含NH4+的物质
D.若生成1molNH4+,则转移电子2mol。
答案
答案:A
从图像可知随着反应的进行S的物质的量增加,应为生成物,则H2S为反应物,NO3-的物质的量减少,应为反应物,则NH4+为生成物。再根据氧化还原反应的原理可写出该反应的离子方程式为:2H++NO3-+4H2S=NH4++4S+3H2O,化学方程式为:2HNO3+4H2S=NH4NO3+4S+3H2O,氧化剂为HNO3,还原剂为H2S,由于2molHNO3中只有1molHNO3发生氧化还原反应,故氧化剂与还原剂的物质的量之比为1:4,A项正确;S为氧化产物,B项错误;含NH4+的物质为还原产物,C项错误;生成1molNH4+,则转移电子8mol,D项错误。
