苯乙烷(

-C2H5)可生产塑料单体苯乙烯(

-CH=CH2),其原理反应是:

-C2H5(g)


-CH=CH2(g)+H2(g);△H=+125kJ•mol-1.某温度下,将0.40mol

-C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(
-C2H5)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
| n(
-CH=CH2)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(2)工业上常以高温水蒸气作为反应体系的稀释剂(不参与反应).

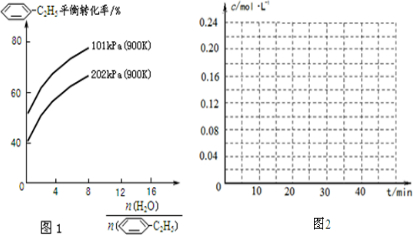
-C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将______(填“越大”、“越小”或“不变”),原因是______.
(3)副产物H2用做氢氧燃料电池.写出酸性条件下,该电池正极的电极反应式______.
(4)在相同条件下,若最初向该容器中充入

-CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下

-C2H5(g)和

-CH=CH2(g)的浓度c随时间t变化的曲线______.
(1)20min时,

-C2H5的物质的量为0.26mol,变化的物质的量为0.40mol-0.26mol=0.14mol,
根据方程式

-C2H5(g)


-CH=CH2(g)+H2(g)可知,
生成

-CH=CH20.14mol,

-C2H5(g)


-CH=CH2(g)+H2(g)
起始:0.40mol 0 0
转化:0.16mol 0.16mol 0.16mol
平衡:0.24mol 0.16mol 0.16mol
平衡时:c(

-C2H5)=0.12mol/L,c(

-CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,
k=
=0.053 mol•L-1,0.08mol/L×0.08mol/L 0.12mol/L
故答案为:0.14; 0.053 mol•L-1;
(2)由化学方程式可知,增大压强,平衡向逆反应方向移动,则体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动,所以转化率增大,
故答案为:大;体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动;
(3)酸性氢氧燃料电池中,正极上氧气得电子发生还原反应,反应的电极方程式为O2+4H++4e-=2H2O,
故答案为:O2+4H++4e-=2H2O;
(4)在相同条件下,若最初向该容器中充入

-CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,平衡时,c(

-C2H5)=0.12mol/L,c(

-CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,起点(0,0.20)、终点在(40,0.08);苯乙烷曲线变化趋势在增大,弓向浓度轴,且起点(0,0)、终点(40,0.12),则图象为
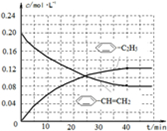
,故答案为:

.
