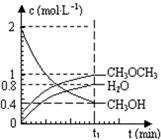
已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=23.5kJ•mol-1.在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示.请回答下列问题:
(1)该条件下反应平衡常数表达式K=______.在T1℃时,该反应的平衡常数为______,达到平衡时n(CH3OH):n(CH3OCH3):n(H2O)=______.
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4mol•L-1、c(H2O)=0.6mol•L-1、c(CH3OCH3)=1.2mol•L-1,此时正、逆反应速率的大小:v (正)______ v (逆)(填“>”、“<”或“=”),反应向______进行(填“正反应方向”或“逆反应方向”).
(1)对于可逆反应2CH3OH(g)⇌CH3OCH3(g)+H2O(g)的平衡常数k=
,c(CH3OCH3)•c(H2O) c2(CH3OH)
由图可知,在t1min时到达平衡,平衡时CH3OH、CH3OCH3、H2O浓度分别为0.4mol/L、1mol/L、0.8mol/L,故平衡常数k=
=c(CH3OCH3)•c(H2O) c2(CH3OH)
=5,1×0.8 0.42
体积相同,物质的量之比等于浓度之比,故n(CH3OH):n(CH3OCH3):n(H2O)=0.4mol/L:1mol/L:0.8mol/L=2:5:4,
故答案为:
,5,2:5:4;c(CH3OCH3)•c(H2O) c2(CH3OH)
(2)此时的浓度商Qc=
=4.5,小于平衡常数5,故反应向正反应进行,v (正)>v (逆),0.6×1.2 0.42
故答案为:>,正反应方向.
