二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25秒内的反应进程.
(1)请计算前20秒内氧气的平均生成速率:
(2)若反应延续至70秒,请在图中用实线画出25秒至70秒的反应进程曲线.
(3)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加催化剂后的反应进程曲线.
(4)写出该反应的化学平衡常数表达式:______.
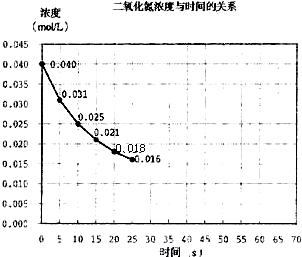
(1)由图可知,20秒内NO2的浓度变化为0.04mol/L-0.018mol/L=0.022mol/L,故v(NO2)
=0.0011mol/(L•s),对于2NO2⇌2NO+O2,速率之比等于化学计量数之比,所以v(O2)=0.022mol/L 20s
v(NO2)=1 2
×0.0011mol/(L•s)=5.5×10-4mol/(L•s),1 2
答:前20秒内氧气的平均生成速率5.5×10-4mol/(L•s);
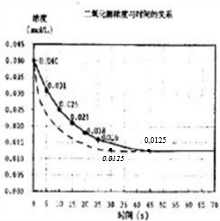
(2)该反应进行到45秒时,达到平衡是NO2浓度约为0.0125mol/L,据此用实线画出25秒至70秒的反应进程曲线为
,
故答案为:

;
(3)若在反应开始时加入催化剂(其他条件都不变),反应速率加快,相同时间内NO2浓度变化量增大,到达平衡时间缩短,但不影响平衡移动,达到平衡是NO2浓度约为0.0125mol/L,据此用虚线画出加催化剂后的反应进程曲线为

,
故答案为:

;
(4)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,对于可逆反应2NO2⇌2NO+O2的平衡常数k=
,c2(NO)•c(O2) c2(NO2)
故答案为:
.c2(NO)•c(O2) c2(NO2)
