甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和反应②,用CH4和H2O为原料来制备甲醇(CH3OH).
①CH4(g)+H2O(g) CO(g)+3H2(g)△H1
②CO(g)+2H2(g) CH3OH(g)△H2
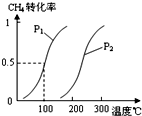
将0.20mol CH4和0.30mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生①反应,达到平衡时,CH4的转化率与温度、压强的关系如图.
(1)温度不变,缩小体积,增大压强,①的反应速率______(填“增大”、“减小”或“不变”),平衡向______方向移动.
(2)反应①的△H1______0(填“<”、“=”或“>”).
(3)如果反应①达到平衡时所用的时间为2min,求CH4的反应速率及化学平衡常数的值.(写出计算过程).
(4)在100℃压强为0.1MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下进行②反应,生成甲醇.为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.请在下表空格中填入剩余的实验条件数据.
| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) | ||
| I | 150 |
| 0.1 | ||
| II | 5 | ||||
| III | 350 | 5 |
(1)温度不变,缩小体积增大压强,反应速率增大,平衡向气体体积减小的方向移动,即反应①向逆反应移动,
故答案为:增大;逆反应;
(2)采取控制变量法分析,由图可知压强相同时,到达平衡时,温度越高CH4的转化率越大,升高温度平衡向正反应移动,故正反应为吸热反应,即△H>0,
故答案为:>;
(3)由100℃平衡CH4的转化率为0.5可知,消耗CH4为0.2mol×0.5=0.1mol,平衡时甲烷的浓度变化量为
=0.01mol/L,故v(CH4)=0.1mol 10L
=0.005mol/(L•min);0.01mol/L 2min
平衡时甲烷的浓度变化量为
=0.01mol/L,则:0.1mol 10L
CH4(g)+H2O(g)⇌CO(g)+3H2(g)
开始(mol/L):0.02 0.03 0 0
变化(mol/L):0.01 0.01 0.01 0.03
平衡(mol/L):0.01 0.02 0.01 0.03
故100℃时平衡常数k=
=1.35×10-3,0.033 ×0.01 0.02×0.01
答:CH4的反应速率为0.005mol/(L•min);100℃时平衡常数化学平衡常数的值为1.35×10-3;
(4)通过“控制变量法”探究外界条件对化学平衡的影响,探究的前提只能是改变一个条件,而其它条件不变,由此可得:Ⅱ中温度为150℃,n (CO)/n(H2)为
,Ⅲ中n (CO)/n(H2)为1 3
,1 3
故答案为:
| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) | ||
| I | |||||
| II | 150 |
| |||
| III |
|

 的眼光,一种
的眼光,一种 出来,
出来, 出来,
出来, 出来,不乏小小的机敏,不乏油腔滑调,也不乏嘲弄讥刺毁誉褒贬。
出来,不乏小小的机敏,不乏油腔滑调,也不乏嘲弄讥刺毁誉褒贬。