(14分)某温度时,将0.200mol的A气体充入2L抽空的密闭容器中,隔一定的时间对该容器内的物质进行分析,得到如下数据:
| 时间(S)浓度 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A)mol•L-1 | 0.100 | 0.070 | 0.050 | c3 | a | b |
| c(B)mol•L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(1)该反应的化学方程式为______,表中c2______c3、a______b(填>、<、=),若在相同情况下最初向该容器充入的是B气体,要达到上述同样的平衡状态,B的起始浓度是______mol•L-1.
(2)在体积为l L的密闭容器中,充入lmol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
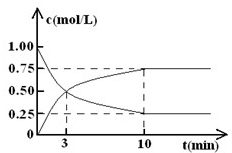
(I)从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=______;
该反应的平衡常数k=______.
(II)乙醇是重要的化工产品和液体燃料,同样可以利用CO2反应制取乙醇:
2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
在一定压强下,测得反应的实验数据如下表.分析表中数据回答下列问题:
| 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
②提高氢碳比[n(H2)/n(CO2)],K值______(填“增大”、“减小”、或“不变”).
(1)由表中数据可知A为反应物,B为生成物,20s时A的浓度变化量为△c(A)=0.100mol/L-0.070mol/L=0.030mol/L;B的浓度为0.06mol/L,浓度变化量之比等于化学计量数之比,所以方程式为A(g)=2B(g);
由表中数据可知40s时A的浓度变化量为△c(A)=0.100mol/L-0.050mol/L=0.050mol/L,所以此时B的浓度为C2=2×0.05mol/L=0.1mol/L,60s时B的浓度为0.12mol/L,所以此时△c(A)=
×0.12mol/L=0.06mol/L,所以C3=0.1mol/L-0.06mol/L=0.04mol/L,所以C2>C3;1 2
由表中数据可知从60S起,B的浓度不再变化,说明60s起反应达平衡,平衡后各组分的浓度不再发生变化,所以a=b;
恒温恒容下,把B按化学计量数转化到A,应满足与原平衡A的浓度相等,所以B的起始浓度为2×0.1mol/L=0.2mol/L.
故答案为:A(g)=2B(g);C2>C3;a=b;0.2;
(2)(I)由图可知10min时,反应达平衡状态,此时甲醇浓度为0.75mol/L,
所以甲醇的平均反应速率v(CH3OH)=
=0.075 mol•L-1•min-1,0.75mol/L 10min
CO2(g)+3H2(g)
CH3OH(g)+H2O(g)一定条件
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
所以k=
=c(CH3OH)•c(H2O) c(CO2)•[c(H2)]3
=0.75×0.75 0.25×(0.75)3
,16 3
故答案为:0.075 mol•L-1•min-1;
;16 3
(II)①由表可知当为n(H2)/n(CO2)为定值时,温度越高二氧化碳的转化率越低,平衡向逆反应进行,K值减小,故答案为:减小;
②平衡常数k只受温度影响,温度不变平衡常数k值不变,故答案为:不变.

