某实验需用480 mL 0.2mol/L的稀硫酸溶液,现用密度为1.84g/mL,质量分数为98%浓硫酸配制,请填写下列空白:
(1)需要使用的主要仪器有量筒、烧杯、玻璃棒、 、 。
(2)其操作步骤可分解为以下几步:
A.用量筒量取 mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,
并用玻璃棒搅拌。
B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①完成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):
( D )→( A )→( C )→( )→( )→( )→( F )。
③将浓硫酸在烧杯中稀释后移入容量瓶时,必须_________________方可移液.
(3)试分析下列操作对所配溶液的浓度有何影响
①量取浓硫酸时眼睛俯视刻度线,会导致所配溶液浓度会 ;(填: 偏高、偏低、或无影响,下同)
②定容时,眼睛俯视刻度线,所配溶液浓度会 ;
③定容后,加盖倒转摇匀后,发现溶面低于刻度线,又滴加蒸馏水至刻度。所配溶液浓度会 .
((每空1分,共8分)(1)500 ml容量瓶 胶头滴管
(2)①5.4 ②B→E→G ③冷却至室温 (3)①偏低 ②偏高 ③偏低
题目分析:(1)由于实验室没有480ml的容量瓶,所以应该配制500ml溶液,因此需要的仪器还有500ml容量瓶和定容时的胶头滴管。
(2)①需要浓硫酸的体积是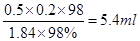 。
。
②转移完硫酸后必须洗涤烧杯和玻璃棒,且洗涤液也要转移到容量瓶中,所以正确的顺序是( D )→( A )→( C )→(B )→(E )→( G )→( F )。
③将浓硫酸在烧杯中稀释后移入容量瓶时,必须冷却至室温方可移液。
(3)根据n=c·V可知,量取浓硫酸时眼睛俯视刻度线,则硫酸的体积减少,则所配溶液浓度会偏低;定容时,眼睛俯视刻度线,则容量瓶中溶液的体积减少,则浓度偏高;定容后,加盖倒转摇匀后,发现溶面低于刻度线,又滴加蒸馏水至刻度,则溶液的体积增加,所配溶液浓度会偏低。
点评:该题是中等难度的试题,试题基础性强,贴近高考。该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严禁的规范实验侧重能力。该题的难点在于误差分析,需要明确的是根据cB=nB/V可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大。