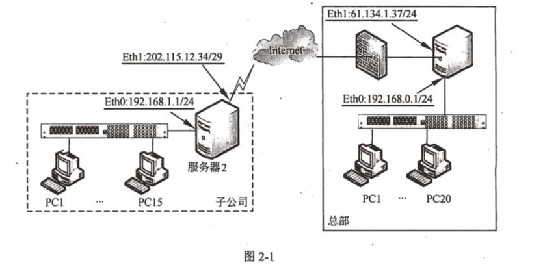
某实验小组查阅资料得知:
5C2O42—+2MnO4—+16H+====10CO2↑+2Mn2++8H2O
欲利用该反应测定某草酸钠(Na2C2O4)样品中草酸钠的质量分数。该小组称量1.34 g草酸钠样品溶于稀硫酸中,然后用0.200 mol·L-1的酸性高锰酸钾溶液进行滴定(其中的杂质不跟高锰酸钾和稀硫酸反应)。
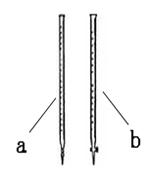
(1)滴定时用______(填a或b)。
(2)滴定管盛装KMnO4标准溶液。滴定前______(填“是”或“否”)滴加指示剂,滴定终点的现象是____________________。
(3)达到终点时消耗了15.00 mL的高锰酸钾溶液,样品中草酸钠的质量分数为______________。
(共5分)
(1)b (1分)
(2)否 (1分),溶液颜色由无色变为紫色,且半分钟内溶液颜色不再改变(1分)
(3)75% (2分)
题目分析:(1)高锰酸钾具有强氧化性,腐蚀橡皮管,应用酸式滴定管,故答案为:b;
(2)高锰酸钾溶液为紫红色,当达到滴定终点时,再滴入高锰酸钾溶液时,紫红色不再褪去,故答案为:否;KMnO4溶液呈紫红色,达滴定终点紫色不再褪去;(3)草酸钠(Na2C2O4)溶于稀硫酸中,然后用酸性高锰酸钾溶液进行滴定,离子方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O. n(KMnO4)=0.015L×0.200mol•L-1=3×10-3mol,根据方程式可得:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
2 5
3×10-3mol 7.5×10-3mol
样品中草酸钠的质量为m=7.5×10-3mol×134g/mol=7.5×134×10-3g,
样品中草酸钠的质量分数为(7.5×134×10-3g)/1.34g×100%=75%,
故答案为:75%。
点评:本题主要结合实验考查了外界条件对化学反应速率的影响,质量分数的计算,注意把握实验的原理,要求具备一定的理论分析能力和计算解决问题的能力。