氯化铝为白色的粉末,遇潮湿空气极易吸收水分并部分水解放出氯化氢而形成酸雾,在183℃升华。工业上由金属铝和氯气作用或用碳氯化法可制得无水氯化铝。某课外兴趣小组在实验室中,通过下图装置制取少量纯净的无水氯化铝。
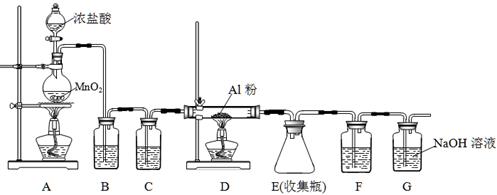
(1)装置A中用于盛装浓盐酸的仪器名称是 ,装置A可产生氯气和MnCl2溶液,该反应的化学方程式是 。
(2)装置B中盛放饱和NaCl溶液,该装置的主要作用是 。
(3)装置C、F均盛放浓硫酸,若取消装置C,则可能产生的不良影响是 。
(4)装置D中预期观察到的现象是剧烈燃烧,发出白光, 。
(5)另选一件仪器装入适当试剂后,也可起到F和G的作用,所装填的试剂名称为 。
(6)工业碳氯化法制无水氯化铝是对氧化铝、碳和氯气进行加热,可得副产品一氧化碳,该反应的化学方程式是 。
(15分)
(1)分液漏斗(1分);4HCl(浓) + MnO2 MnCl2 + 2H2O + Cl2↑(3分)
MnCl2 + 2H2O + Cl2↑(3分)
(2)吸收氯气中混有的氯化氢气体(2分)
(3)产生的氯化铝固体因吸水、水解而混有杂质(2分)
(4)产生白烟(或白色固体)(2分)
(5)碱石灰(或氢氧化钠固体)(2分)
(6)Al2O3 + 3C + 3Cl2 = 2AlCl3 + 3CO(3分)
题目分析:(1)装置A是制取氯气的实验装置,盛装浓盐酸的仪器名称是分液漏斗,盛装MnO2的仪器名称是圆底烧瓶,在加热条件发生反应生成氯气,反应方程式是4HCl(浓) + MnO2 MnCl2 + 2H2O + Cl2↑。
MnCl2 + 2H2O + Cl2↑。
(2)由于HCl易挥发,故装置B中盛放饱和NaCl溶液的主要作用是吸收氯气中混有的氯化氢气体。
(3)浓硫酸具有干燥作用,若若取消装置C,则可能产生的不良影响是产生的氯化铝固体因吸水、水解而混有杂质。
(4)D中发生氯气和铝生成氯化铝的反应,氯化铝为白色的粉末,故有白烟生成。
(5)F和G的作用的防止空气CO2和水份的进入E中,故可选碱石灰。
(6)根据提供的反应物、反应条件和生成物可写成反应的方程式为Al2O3 + 3C + 3Cl2 = 2AlCl3 + 3CO。
点评:实验室制取氯气的注意事项:
1、必须用浓盐酸,稀盐酸不反应.
2、为了减少制得的氯气中氯化氢的含量,所以加热温度不宜过高,浓盐酸具有挥发性.
3、实验结束后,先使反应停止并排出残留的氯气,再拆卸装置,避免污染空气.
4、尾气吸收时,不能用澄清石灰水吸收氯气,因为溶液中含有氢氧化钙的量少,吸收不完全
