S2C12是一种金黄色易挥发的液体,具有强烈的窒息性,在工业生产上可用于橡胶的硫化。为在实验室合成S2C12,某化学研究性学习小组进行了以下探究。
 【查阅资料】① 干燥的氯气在110℃~140℃与硫反应,即可得到S2C12。② S的熔点为112.8℃、沸点为444.6℃;S2C12的熔点为
【查阅资料】① 干燥的氯气在110℃~140℃与硫反应,即可得到S2C12。② S的熔点为112.8℃、沸点为444.6℃;S2C12的熔点为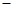 76℃、沸点为138℃。
76℃、沸点为138℃。
③ S2C12+C12 2SCl2。④ S2C12易和水发生反应,生成H2S、SO2、H2SO3、H2SO4等。⑤ClO3-+5Cl-+6H
2SCl2。④ S2C12易和水发生反应,生成H2S、SO2、H2SO3、H2SO4等。⑤ClO3-+5Cl-+6H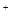 =3C12↑+3H2O 请回答下列问题:
=3C12↑+3H2O 请回答下列问题:
 【实验装置设计】
【实验装置设计】



 (1)B中所放试剂为 ; C中所放试剂为 。
(1)B中所放试剂为 ; C中所放试剂为 。
 (2)在加热D时温度不宜过高,其原因是 ;
(2)在加热D时温度不宜过高,其原因是 ;
为了提高S2C12的纯度,关键的操作是控制好温度和 ;
 (3)G装置的作用是 ;
(3)G装置的作用是 ;
(4)写出工业上制漂白粉的化学方程式 ;
共14分
(1)饱和食盐水(1分) 浓硫酸(1分)
(2)产率降低(或防止发生副反应或产品纯度降低等)(1分)
控制盐酸的滴速不要过快(1分)
(3)防止空气中的水蒸气进入F,吸收尾气(2分)
(4)2C12 + 2Ca(OH)2 =CaC12 + Ca(C1O)2 + 2H2O (2分)
题目分析:(1)A装置是制取C12,B是除去HCl气体,用的是饱和食盐水。C是干燥C12,用的是浓硫酸。
(2)S2C12+C12 2SCl2,故在加热D时温度不宜过高,其原因是产率降低(或防止发生副反应或产品纯度降低等)。为了提高S2C12的纯度,关键的操作是控制好温度和控制盐酸的滴速不要过快,充分反应。
2SCl2,故在加热D时温度不宜过高,其原因是产率降低(或防止发生副反应或产品纯度降低等)。为了提高S2C12的纯度,关键的操作是控制好温度和控制盐酸的滴速不要过快,充分反应。
(3)因为S2C12易和水发生反应,所以G装置的作用是防止空气中的水蒸气进入F,还有吸收尾气。
(4)依据课本知识熟悉方程式,2C12 + 2Ca(OH)2 =CaC12 + Ca(C1O)2 + 2H2O。
点评:本题主要考查了在实验室中合成S2C12,根据题目信息分析原因,培养了学生运用知识的能力与解决问题的能力,综合性较强,难度大。
