有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序增大.C、D都能分别与A按原子个数比为1:1或2:1形成化合物;CB可与EA2反应生成C2A和气态物质EB4;E的M层电子数是K层电子数的2倍.
(1)写出下列元素的名称:A______,B______,E______.
(2)画出E的原子结构示意图______.
写出电子式D2A2______,EB4______.
(3)比较EA2与EB4的熔点高低(填化学式)______>______.
(4)A的氢化物的沸点与同族下一周期元素的氢化物相比,A的氢化物的沸点______(填“高”或“低”),原因是______.
E的M层电子数是K层电子数的2倍,K层容纳2个电子,M层有4个电子,则E为Si元素.
A、B、C、D、E五种短周期元素,核电荷数按C、A、B、D、E的顺序增大.C、D都能分别与A按原子个数比为1:1或2:1形成化合物;CB可与EA2反应生成C2A和气态物质EB4;则C为H元素,A为O元素,D为Na元素;
CB可与EA2反应生成C2A和气态物质EB4;该反应为4HF+SiO2═2H2O+SiF4↑,则B为F元素.
所以A为O元素,C为H元素,B为F元素,D为Na元素,E为Si元素.
(1)由上述分析可知,A为O元素,名称为氧;B为F元素,名称为氟;E为Si元素,名称为硅.
故答案为:氧;氟;硅.
(2)E为Si元素,质子数为14,最外层电子数为4,原子结构示意图为
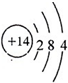
;
D2A2为Na2O2,由钠离子与过氧根离子构成,电子式为
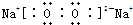
;
EB4为SiF4,硅原子与氟原子之间形成1对共用电子对,电子式为
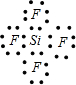
.
故答案为:

;
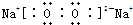
;

.
(3)EA2是SiO2,EB4是SiF4.SiO2为原子晶体,熔沸点较高,SiF4为分子晶体,熔沸点较低,沸点SiO2>SiF4.
故答案为:SiO2;SiF4.
(4)A为O元素,对应氢化物为H2O,与A同族下一周期元素的氢化物为H2S,由于O元素的电负性很强,水分子之间形成氢键,而H2S中不存在氢键,所以水的沸点比H2S的沸点高.
故答案为:高;水分子之间形成氢键,而H2S中不存在氢键.
