已知A、B、C为同一短周期的三种元素,它们的原子序数依次增大且和为40;A是该周期中(除稀有气体元素外)原子半径最大的元素,B元素的原子核外M层上的电子数比K层上的电子数多1.
(1)A原子的结构示意图为______;A元素在周期表中位置为______.
(2)写出B的最高价氧化物与A的最高价氧化物对应水化物的溶液之间反应的离子方程式______.
(3)A和C形成的化合物的电子式为______,该化合物的水溶液呈______性(填“酸”或“碱”).
(4)A是该周期中(除稀有气体元素外)原子半径最大的元素,从原子结构上看其原因是______.A、B、C三元素形成简单离子的半径大小顺序为______.(用离子符号表示)
(5)比较A、B单质活泼性的实验方法是______.
A、B、C为同一短周期的三种元素,B元素的原子核外M层上的电子数比K层上的电子数多1,故B元素有3个电子层,最外层电子数为,故B为Al元素;A是该周期中(除稀有气体元素外)原子半径最大的元素,故A为Na元素;A、B、C的原子序数和为40,故C的原子序数为40-11-13=16,故C为S元素
(1)由上述分析可知,A为Na元素,原子核外有11个电子,有3个电子层,最外层电子数为1,原子的结构示意图为
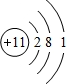
;Na元素在周期表中位置为第三周期第ⅠA族.
故答案为:
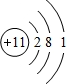
;第三周期第ⅠA族.
(2)B的最高价氧化物为Al2O3,A的最高价氧化物对应水化物为NaOH,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
故答案为:Al2O3+2OH-=2AlO2-+H2O.
(3)A和C形成的化合物是Na2S,属于离子化合物,由钠离子与硫离子构成,电子式为

;硫化钠溶液中硫离子水解,使溶液呈碱性.
故答案为:

;碱.
(4)同周期元素中Na元素原子的核电荷数最小,对最外层电子的引力越强,原子半径最大;最外层电子数相同电子层越多离子半径越多,电子层结构相同核电荷数越多离子半径越小,故离子半径S2->Na+>Al3+.
故答案为:电子层相同,核电荷数越小,对最外层电子的引力越,原子半径越大;S2->Na+>Al3+.
(5)利用金属钠与去掉氧化膜的铝与水或盐酸反应,反应越剧烈,金属性越强,单质越活泼.
故答案为:利用金属钠与去掉氧化镁的铝与水或盐酸反应,反应越剧烈,金属性越强,单质越活泼.
