A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.己知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.
(1)C元素在周期表中的位置______.
(2)A元素与水反应的离子方程式是______.
(3)写出C元素的单质从A、B两元素组成的化合物的水溶液中置换出B元素的单质的化学方程式______.
(4)BD2和C2均具有漂白性,二者的漂白原理______.(填“相同”或“不同”)
(5)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:3H2+N2
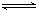
2NH3△H=-92.4kJ•mol-1
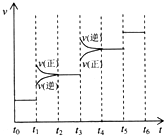
①当合成氨反应达到平衡后,改变某一外界条件 (不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.图中t1时引起平衡移动的条件可能是______,其中表示平衡混合物中NH3的含量最高的一段时间是______.
②温度为T℃时,将2a molH2和a molN2放入0.5L 密闭容器中,充分反应后测得N2的转化率为50%.则该反应的平衡常数为______.
由A、B、C、D四种短周期元素,己知D元素的一种单质是日常生活中饮水机常用的消毒剂,即利用臭氧来作消毒剂,则D为氧元素;B、D同主族,则B为硫元素;A、B、C同周期,A的原子半径是同周期中最大的,则A为钠元素;C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质,即C的非金属性比B的强,则C为氯元素;
(1)因C为氯元素,其质子数为17,电子排布中有3个电子层,最外层电子数为7,即其位置为第三周期、第 VIIA族,故答案为:第三周期、第 VIIA族;
(2)因A为钠元素,钠和水反应生成氢氧化钠和氢气,则离子反应为2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)因C元素的单质为氯气,A、B两元素组成的化合物的水溶液为Na2S的溶液,氯气的氧化性大于硫的,则发生反应为Cl2+Na2S=2NaCl+S↓,故答案为:Cl2+Na2S=2NaCl+S↓;
(4)二氧化硫能漂白某些有色的物质是化合生成暂时稳定的无色物质,而氯气漂白是利用其强氧化性使有色的物质褪色,则原理不同,故答案为:不同;
(5)①由图象可知,t1时正逆反应速率都增大,则可能为加压或升温,该反应为放热反应,升高稳定,逆向移动,逆反应速率大于正反应速率,与图象不符,该反应是气体体积缩小的反应,加压正向移动,则正反应速率大于逆反应速率,与图象符合,则应为加压;显然图象中的t3时为升高温度,t1时加压正向移动,氨气的含量增大,t3时为升高温度,化学平衡逆向移动,氨气的含量降低,即t2-t3一段时间平衡混合物中NH3的含量最高;故答案为:加压;t2-t3;
②2a molH2和a molN2放入0.5L 密闭容器中,充分反应后测得N2的转化率为50%,则
3H2+N2
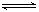
2NH3
开始(mol/L)4a 2a 0
转化 3a a 2a
平衡 a a 2a
则该温度下反应的化学平衡常数为K=
=(2a)2 a3×a
,故答案为:4 a2
.4 a2
