孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O的步骤如下:
|
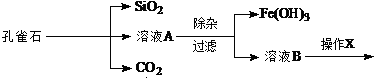
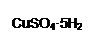 为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:| 物质 | pH (开始沉淀) | pH(完全沉淀) |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
,需调节溶液pH的范围为 。
(2)操作X包括 蒸发浓缩、冷却结晶、过滤和洗涤等。在进行该操作时,需要将溶液B再
适当酸化目的 。
(3)若向溶液B中逐滴加入NaOH溶液,刚好出现沉淀时,请写出存在的难溶物质的沉淀溶解平衡方程式为
(4) 为准确测定溶液A中含有Fe2+的物质的量浓度,实验如下:
①取出25.00mL溶液A,配制成250 mL 溶液。
②滴定:准确量取25.00ml所配溶液于锥形瓶中,将0.20mol/LKMnO4溶液
装入 ,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
(反应式: 5Fe2+ + MnO4— +10 H+ = 5Fe3+ + Mn2+ + 5H2O)
③ 计算溶液A中Fe2+的物质的量浓度= mol/L (只列出算式,不做运算)。
⑴ 升高溶液的pH,促进Fe3+水解生成Fe(OH)3沉淀(3分);3.2-4.7(2分)
⑵ 抑制Cu2+的水解 (3分) (3) Cu(OH)2(s) Cu 2+(aq) + 2OH -(aq) (2分)
Cu 2+(aq) + 2OH -(aq) (2分)
(4)②酸式滴定管(2分) ③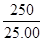 ×0.20×V×10-3×5 /25 ×10-3 (2分)
×0.20×V×10-3×5 /25 ×10-3 (2分)
题目分析:(1)要除去、Fe3+离子,就需要调节溶液的pH值,且还不能引入新的杂质,所以氧化铜的作用就是升高溶液的pH,促进Fe3+水解生成Fe(OH)3沉淀。氢氧化铜开始沉淀时的pH值是4.7,氢氧化铁完全沉淀时的pH值时3.2,所以pH的范围是3.2~4.7。
(2)由于铜离子在溶液中也水解,所以再次酸化的目的是抑制Cu2+的水解。
(3)氢氧化铜的沉淀溶解平衡方程式是Cu(OH)2(s) Cu 2+(aq) + 2OH -(aq)。
Cu 2+(aq) + 2OH -(aq)。
(4)②由于高锰酸钾具有强氧化性,则只能用酸式滴定管盛装高锰酸钾溶液。
③根据反应的方程式可知,1mol高锰酸钾能氧化5mol亚铁离子,所以根据消耗的高锰酸钾的物质的量可知,溶液A中Fe2+的物质的量浓度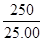 ×0.20×V×10-3×5 /25 ×10-3mol/L。
×0.20×V×10-3×5 /25 ×10-3mol/L。
点评:该题是高考中的常见题型,难度大,综合性强,对学生的要求高。试题在注重对基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生规范严谨的实验设计能力以及评价能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
