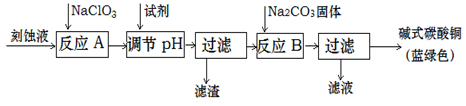
碱式碳酸铜是一种用途广泛的化工原料。工业上可用酸性刻蚀废液(主要含有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如下:
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物 质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
(1)滤渣的主要成分是 (写化学式)。
(2)调节反应A后溶液的pH范围应为 。选择的试剂最合适的是 (填序号)。
a.氨水 b.稀硫酸 c.氢氧化钠 d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是 。
(4)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀。用相应的离子方程式表示:
① 沉淀只有CuCO3: ;
② 沉淀只有Cu(OH)2且放出气泡: 。
(5)碱式碳酸铜的组成可表示为:aCuCO3•bCu(OH)2•cH2O。要测定其组成,甲同学设计的实验方案中需要如下五个步骤:①称量样品的质量;②高温分解;③测出CO2的质量;④测出水蒸汽的质量;⑤称量CuO的质量。而乙同学认为除步骤②外,实验只需测定四个量中的三个即可,则合理的组合为 (填序号,写一组即可)。
(15分,除注明外每空2分)
(1)Fe(OH)3 ; (2)3.2~4.2; d; (3)CuO(名称亦可);
(4)①Cu2++CO32-=CuCO3↓;②Cu2++CO32-+H2O= Cu(OH)2↓+ CO2↑;
(5)①③④(或①③⑤、①④⑤)(3分)
题目分析:(1)对比原料和目标产物的成分,可以猜测该流程各个步骤的主要目的,反应A是为了氧化亚铁离子,调节pH是为了使铁离子全部变为氢氧化铁沉淀,过滤是为了除去铁元素,因此滤渣的主要成分是Fe(OH)3,反应B是制取碱式碳酸铜,第二次过滤是为了除去可溶性盐;(2)读表中信息,根据流程中原料和目标产物的组成,调节溶液pH时,应使铁离子完全沉淀,而铜离子不能开始沉淀,因此溶液pH应介于3.2~4.2之间;若选择氨水,会引入铵根离子等杂质,故a选项错误;若选择稀硫酸,会引入硫酸根离子等杂质,故b选项错误;若选择氢氧化钠,会引入钠离子等杂质,故c选项错误;若选择碳酸铜,不仅能除去杂质,而且引入的铜离子能增大目标产物的量,故d选项正确;(3)若反应B的温度过高,产生的碱式碳酸铜可能分解生成黑色的氧化铜固体,使制备的目标产物不纯;(4)碳酸根离子与铜离子结合生成碳酸铜沉淀,即Cu2++CO32-=CuCO3↓;铜离子与碳酸根离子发生双水解反应,生成氢氧化铜沉淀和二氧化碳气体,即Cu2++CO32-+H2O= Cu(OH)2↓+ CO2↑;(5)碱式碳酸铜高温分解的原理为:aCuCO3•bCu(OH)2•cH2O  (a+b)CuO+(b+c)H2O↑+aCO2↑,由于各物质的摩尔质量数值上等于式量,n=m/M,该反应中碱式碳酸铜、氧化铜、水蒸气、二氧化碳的系数之比等于物质的量之比,只需要进行①③④(或①③⑤、①④⑤)实验,就可以计算出碱式碳酸铜的组成中a、b、c的值。
(a+b)CuO+(b+c)H2O↑+aCO2↑,由于各物质的摩尔质量数值上等于式量,n=m/M,该反应中碱式碳酸铜、氧化铜、水蒸气、二氧化碳的系数之比等于物质的量之比,只需要进行①③④(或①③⑤、①④⑤)实验,就可以计算出碱式碳酸铜的组成中a、b、c的值。