现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | 能形成双原子分子,原子间存在3对共用电子对 |
| X | M层有3个电子 |
| Y | 最外层电子数是最内层电子数2倍,其最高氧化物是一种固体,用于生产光导纤维 |
| Z | 最高正价为+7价 |
(2)X的最高价氧化物与烧碱反应的离子反应方程式为:______.
(3)Z的非金属性比T元素强,用化学方程式表示:______.
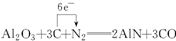
(4)XT是一种新型的无机材料,可由X的最高价氧化物与T的单质及焦炭反应生成,逸出的气体具有可燃性,写出反应方程式,并标出电子转移方向和数目.______.
由能形成双原子分子,原子间存在3对共用电子对知,T元素最外层5个电子,主族元素的族序数=其最外层电子数,T是氮元素;
由M层有3个电子知,其核外电子排布是2、8、3,故X是铝元素;
由最外层电子数是最内层电子数2倍,其最高氧化物是一种固体,用于生产光导纤维,光导纤维的主要是二氧化硅,所以Y是硅元素;
由最高正价为+7价,主族元素的族序数=其最外层电子数,且是短周期元素,氟没有正化合价,所以是氯元素.
(1)Z是氯元素,最外层7个电子,容易得一个电子达到8电子稳定结构,离子结构示意图为
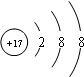
,Y形成的最高价氧化物是二氧化硅,硅最外层4个电子,易形成4个共价键,故答案为:

;4;
(2)X的最高价氧化物是Al2O3,Al2O3是两性氧化物,既能和强酸反应又能和强碱反应生成盐和水,
故答案为:Al2O3+2OH-+3H2O═2[Al(OH)4]-;
(3)Z的非金属性比T元素强,判断非金属性的方法有:非金属间的置换反应,其最高价氧化物的水化物的酸性强弱,其气态氢化物的稳定性等,
故答案为:3Cl2+2NH3═N2+6HCl(或3Cl2+8NH3═N2+6NH4Cl);
(4)由题意知,XT是AlN,X的最高价氧化物是Al2O3,根据元素守恒知,逸出具有可燃性的气体是CO,碳是还原剂,氮气是氧化剂,故答案为:
.
