现有四种短周期元素X、Y、Z、W,其中:
①X、W原子的电子层数与最外层电子数之比分别为3:1和 1:3
②Y原子是元素周期表中原子半径最小的
③Z是形成化合物种类最多的元素
回答下列问题:
(1)X元素在周期表中的位置是______.
(2)上述四种元素中,只由一种元素的原子构成的离子是______(填离子符号).
(3)化合物X2W2的电子式是______.
(4)向含1mol Na2SiO3的溶液中缓慢通入2mol的ZO2,反应的离子方程式是______.反应后溶液中阴离子浓度由大到小的顺序是______.
(5)由Y、Z、W元素中的两种或三种可以组成多种分子,其中含有18个电子的分子是______(填化学式).
(6)用KMnO4溶液可以通过滴定来测定Y2Z2W4溶液的物质的量浓度.向25.00mL 的Y2Z2W4溶液中加入5.00mL 0.50mol/L酸性KMnO4溶液恰好完全反应,得到ZO2和Mn2+,则此种Y2Z2W4溶液的物质的量浓度是______mol/L.
四种短周期元素X、Y、Z、W,由①X、W原子的电子层数与最外层电子数之比分别为3:1和 1:3,则X有3个电子层,最外层电子数为1,即X为Na,W有2个电子层,最外层电子数为6,即W为O;由②Y原子是元素周期表中原子半径最小的,则Y为H;由③Z是形成化合物种类最多的元素,则Z为C元素.
(1)Na原子结构中有3个电子层,最外层电子数为1,则位于第三周期、第ⅠA族,故答案为:第三周期、第ⅠA族;
(2)金属易失去电子,非金属易得电子,但H失去电子为阳离子,则四种元素的离子为Na+、H+、O2-、O22-、C22-,故答案为:Na+、H+、O2-、O22-、C22-;
(3)化合物X2W2为Na2O2,其电子式为
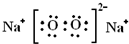
,故答案为:
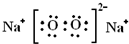
;
(4)因碳酸的酸性大于硅酸的酸性,则二氧化碳足量生成碳酸氢钠,发生离子反应为2CO2+2H2O+SiO32-═2HCO3-+H2SiO3↓,
反应后生成2molNaHCO3,水解显碱性,且水解大于电离,所以溶液中阴离子浓度由大到小的顺序为c(HCO3-)>c(O H-)>c(CO32-),
故答案为:2CO2+2H2O+SiO32-═2HCO3-+H2SiO3↓;c(HCO3-)>c(O H-)>c(CO32-);
(5)因原子的质子数等于电子数,则上述元素的原子形成的18电子分子有H2O2、CH4O、C2H6,
故答案为:H2O2、CH4O、C2H6;
(6)向25.00mL 的Y2Z2W4溶液中加入5.00mL 0.50mol/L酸性KMnO4溶液恰好完全反应,得到ZO2和Mn2+,则C元素由+3价升高到+4价,
Mn元素由+7价降低为+2,设Y2Z2W4溶液的物质的量浓度为x,由电子守恒可知,0.025L×x×2×(4-3)=0.005L×0.5mol/L×(7-2),
解得x=0.25mol/L,故答案为:0.25.
