A、B、C、D、E、F、G全为短周期元素,它们在中学常见化合物中显示的部分化合价及原子、离子半径从大到小的序号如下:(注:半径按①、②、③…的顺序依次减小)
| 元素 性质 | A | B | C | D | E | F | G |
| 化合价 | +1、+5、+7 | 只有+2 | +4 | -3、+2、+4、+5 | 只有-1 | 只有+3 | 只有+1 |
| 原子半径 | ⑤ | ② | ④ | ⑥ | ⑦ | ③ | ① |
| 离子半径 | ① | ⑤ | 无离子 | ② | ③ | ⑥ | ④ |
(2)写出F的最高价氧化物对应的水化物和G的最高价氧化物对应的水化物反应的离子方程式______.
(3)请设计实验比较B、F的活动性强弱.
| 元素 | 实验设计 | 现象 | 结论 |
| B | 活动性:B F (填“>”、“<”或“=”) | ||
| F |
A的最高正价为+7价,为第ⅦA族元素,对应离子半径最大,则应为Cl元素,B的化合价只有+2价,为第ⅡA族元素,根据原子半径判断应为Mg元素,C的化合价为+4价,且原子半径大于Cl,应为Si元素,D的化合价为-3、+2、+4、+5,可以判断应为N元素,E只有-1价,应为F元素,F只有+3价,应为Al元素,G只有+1价,且原子半径最大,应为Na元素,
(1)A为Cl元素,B为Mg元素,二者形成的化合物为离子化合物,用电子式表示的形成过程为
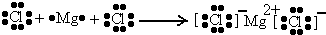
,
故答案为:
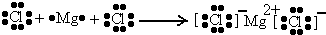
.
(2)F为Al元素,最高价氧化物对应的水化物为Al(OH)3,具有两性,G的最高价氧化物对应的水化物为NaOH,二者反应生成偏铝酸钠和水,反应的离子方程式为
Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
(3)B为Mg元素,F为Al元素,Mg的金属性较Al强,可用金属与稀硫酸反应,比较反应的剧烈程度,金属越活泼,与酸反应越剧烈,故答案为:
| 元素 | 实验设计 | 现象 | 结论 |
| B | 分别将金属加入等物质的量浓度的稀硫酸溶液中,比较反应速率的大小 | 加入镁条的烧杯中产生气泡较Al剧烈 | > |
| F |
