X、Y、Z、M、N、K是由短周期元素构成的微粒,其中X、Y、Z是阳离子,M、N是中性分子,K是阴离子,它们具有下列结构特点和性质:
①它们核外电子总数都相同;
②N溶于M中,滴入酚酞,溶液变红;
③X和N都由A、C两元素组成,X和Y核内质子数相等;
④Y和K都由A、B两元素组成,Y核内质子总数比K多两个;
⑤Z为单核离子,且离子半径是与其具有相同电子层结构离子中半径最小的.
根据以上信息,请回答下列问题:
(1)Y的化学式为______,X的电子式为______.
(2)试比较M和N的稳定性:M______N(填“>”、“<”、“=”)
(3)检验X的方法是______.
(4)由A、B、C三种元素组成的物质中,属于离子化合物的有______,属于共价化合物的有______(各任写一种物质的化学式)
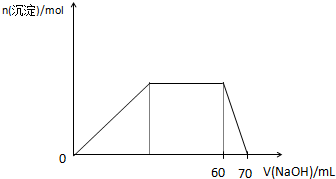
(5)上述六种微粒中的两种可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入0.1mol/L氢氧化钠溶液,随着氢氧化钠溶液的加入,产生沉淀的关系如图,则该复盐的化学式为______.
根据 ②N溶于M中可初步判定M为H2O(最常见的溶剂);
再由①知都是10电子,N的水溶液显碱性,所以N为NH3(中学化学中唯一的碱性气体);
由③中A、B两种元素形成的阴阳离子质子数差2,则Y为H3O+,K为OH-,A、B为H、O两元素;
由④知:X为NH4+,则C为N元素;
Z为单核离子,且离子半径是与其具有相同电子层结构离子中半径最小的,则Z为铝离子,则
(1)Y为H3O+,X为NH4+,电子式为
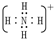
,故答案为:H3O+,
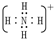
;
(2)M为H2O,N为NH3,由于非金属性:O>N,元素的非金属性越强,对应的氢化物越稳定,则稳定性:H2O>NH3,故答案为:>;
(3)检验,可根据NH4+与OH-反应生成碱性气体NH3,能使湿润的红色石蕊试纸变蓝进行检验,
故答案为:用试管取含X的溶液少量,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体;
(4)A、B为H、O元素,C为N元素,形成的离子化合物有NH4NO3、NH4NO2等,共价化合物有HNO3、HNO2等,
故答案为:NH4NO3等;HNO3等;
(5)能生成白色沉淀,说明含有Al3+,开始发生:Al3++3OH-=Al(OH)3↓,然后沉淀的质量不变,则应发生:NH4++OH-=NH3•H2O,最后发生:Al(OH)3+OH-=AlO2-+2H2O,根据图象横坐标可知:n(NH4+):n(Al3+)=3:1,则该复盐的化学式为(NH4)3 Al(SO4)3或3(NH4)2 SO4﹒Al2(SO4)3,
故答案为:(NH4)3 Al(SO4)3或3(NH4)2 SO4﹒Al2(SO4)3.
