氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组拟选用如下装置制备氢化钙。
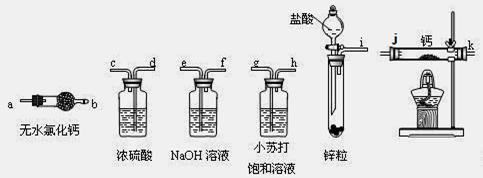
回答下列问题:
(1)检查装置E气密性的操作方法是 。
(2)利用上述装置制取氢化钙时按气流方向连接顺序为i→___→___→___→ → → →a(填仪器接口的字母编号)。
(3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;__________________(请按正确的顺序填入下列步骤的标号)。
A.加热反应一段时间
B.收集气体并检验其纯度
C.关闭分液漏斗活塞
D.停止加热,充分冷却(4)写出CaH2与水反应的化学方程式_________________________________________ ;登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是_______________。
(10分)(每空2分)
(1)方法一:关闭i口,打开分液漏斗活塞,从分液漏斗中加入蒸馏水,若蒸馏水不能流下,则装置气密性良好。
方法二:用导管连接i口,并将导管另一端放入水中,微热试管,若导管口有气泡冒出,则装置气密性良好。
冷却后导管中形成一段水柱,则装置气密性良好。(2分,其它方法正确也可得分)
(2)i→e,f→d,c→j,k(或k,j)→a (2分,只要有1处错0分)
(3)BADC(2分)
(4)CaH2+2H2O=Ca(OH)2+2H2↑ (2分) 氢化钙是固体,携带方便(2分)
(1)检查装置E气密性的原理是想办法产生压强差,并产生某种明显现象,常用方法有:①关闭i口,打开分液漏斗活塞,从分液漏斗中加入蒸馏水,若蒸馏水不能流下,则装置气密性良好;②用导管连接i口,并将导管另一端放入水中,微热试管,若导管口有气泡冒出,则装置气密性良好;(2)氢前金属锌易与盐酸发生置换反应,并放出热量和气体,盐酸是挥发性酸,则所得氢气中含有的杂质是HCl、H2O,杂质也能与钙单质反应,使制得的CaH2固体不纯,因此需要除去HCl、H2O;根据除去旧杂质不能引入新杂质的原则,应该先用NaOH溶液洗气,再用浓硫酸洗气,即先除去HCl后除去H2O,然后将纯净的氢气与钙反应,虽然不需要尾气处理装置,但是还要连接1个干燥装置,因为要防止空气中的水蒸气进入装置与钙单质及CaH2反应,根据上述过程选择装置、仪器并连接为i→e,f→d,c→j,k(或k,j)→a;(3)加入药品后,打开活塞,先收集氢气并验纯,排尽装置中的空气后,再加热使氢气和钙充分反应,结束反应时应先停止加热,继续通入氢气使其冷却至常温后,最后关闭活塞,停止制氢;(4)金属氢化物是常用还原剂,水是氧化剂,二者反应放出氢气、生成氢氧化钙,即CaH2+2H2O=2H2↑+Ca(OH)2;氢气是易燃易爆的气体,携带不方便,也不安全,而氢化钙是固体,携带方便,与水易反应放出可以作燃料的氢气,这就是二者的区别。
