SO2是一种重要的化工原料,也是引起酸雨污染的重要来源。
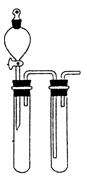
(1)某兴趣小组采用如图所示装置制取SO2
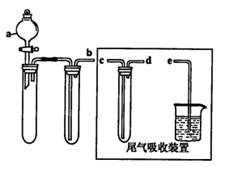
①下列实验方案适用如图所示装置制取所需SO2的试剂是_______(填序号)。
A.Na2SO3溶液与稀硝酸
B.Na2SO3固体与浓硫酸
C.固体硫和氧气
D.铜与浓硫酸②a的仪器名称是_______。
③尾气吸收装置的连接顺序是b接( )接 ( )接e。
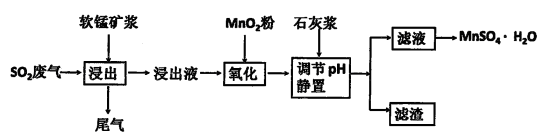
(2)为了回收利用SO2废气,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体( 生产流程,其流程示意图如下:
生产流程,其流程示意图如下:
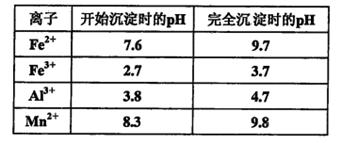
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
请回答:
①含Al3+的盐常用作净水剂,用离子方程式表示其净水原理________________________。
②浸出过程中主要反应的化学方程式是___________________________________________。
③氧化过程中加入MnO2粉的目的是______________________________________________;
反应的离子方程式是_________________________________________________________。
④用石灰浆调节pH,pH应调节的范围是___________________________________。
⑤滤渣的主要成分是____________________________________。
(1)①B (2分)
②分液漏斗 (2分)
③d c (2分)
(2)①Al3++3H2O  Al(OH)3+3H + (2分)
Al(OH)3+3H + (2分)
②SO2+MnO2=MnSO4 (2分)
③将Fe2+氧化为Fe3+ (2分)
2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O (2分)
④4.7≤pH<8.3 (2分)
⑤氢氧化铁、氢氧化铝、硫酸钙 (2分)
(1)①该装置属于固液或液液混合不加热型装置
A、Na2SO3溶液与HNO3反应时,硝酸会氧化亚硫酸钠本身被还原为一氧化氮,故A不符合;
B、Na2SO3固体与浓硫酸不加热反应,利用浓硫酸难挥发性可以反应生成二氧化硫气体,故B符合;
C.硫燃烧不需要分液漏斗,故C不符合;
D.铜和浓硫酸反应需要加热,故D不符合;
故选B;
②a的仪器名称是:分液漏斗,答案:分液漏斗;
③如图,尾气吸收装置的连接顺序是b接(d)接 (c)接e。答案:d c 。
(2)①含Al3+的盐常用作净水剂,是利用Al3+ 水解产生的Al(OH)3胶体,具有吸附性,吸附水中的悬浮的杂质,离子方程式为①Al3++3H2O  Al(OH)3+3H + ,答案:Al3++3H2O
Al(OH)3+3H + ,答案:Al3++3H2O  Al(OH)3+3H + ; ②低品位软锰矿浆的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金属离子主要是Mn2+,则MnO2与SO2发生氧化还原反应的化学方程式为SO2+MnO2=MnSO4,
Al(OH)3+3H + ; ②低品位软锰矿浆的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金属离子主要是Mn2+,则MnO2与SO2发生氧化还原反应的化学方程式为SO2+MnO2=MnSO4,
故答案为:SO2+MnO2=MnSO4 ;③杂质离子中只有Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+,反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O,
故答案为:将Fe2+氧化为Fe3+ 2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O ;④溶液中加入石灰浆来调节pH,其作用是除去杂质中含有Fe3+、Al3+阳离子,从图表以看出,大于4.7可以将Fe3+和Al3+除去,小于8.3是防止Mn2+也沉淀,所以只要调节pH值在4.7~8.3间即可,
故答案为:4.7≤pH<8.3 ;⑤Fe3+、Al3+阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀,同时生成微溶的硫酸钙,所以滤渣主要有氢氧化铁、氢氧化铝、硫酸钙.
故答案为:氢氧化铁、氢氧化铝、硫酸钙 2废气
