不久前,一则“食用撒了鱼浮灵的鱼虾可能致癌”的微博在网上热传。“鱼浮灵”的化学成分实为过碳酸钠,使用不当会让鱼损伤,过碳酸钠本身无毒无害,对人体不会有危害。过碳酸钠,俗称固体双氧水,化学式为2Na2CO3·3H2O2,是一种无机盐,是白色颗粒状粉末,可以分解为碳酸钠和过氧化氢。某探究小组制备过碳酸钠并测定样品中H2O2的含量,其制备流程和装置示意图如下:
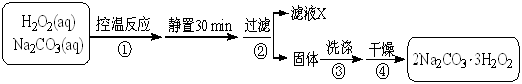
已知:50 °C时 2Na2CO3·3H2O2 (s) 开始分解
主反应 2Na2CO3 (aq) + 3H2O2 (aq) 2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
副反应 2H2O2 = 2H2O + O2↑
滴定反应 6KMnO4 + 5(2Na2CO3·3H2O2) +19H2SO4 = 3K2SO4 + 6MnSO4+10Na2SO4 + 10CO2 ↑ + 15O2↑ + 34H2O
根据以上信息回答下列问题:
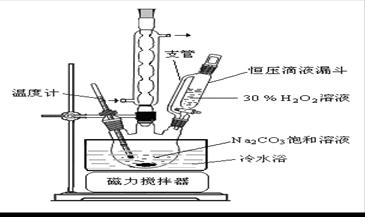
(1)推测图中支管的作用可能是 。
(2)步骤①的关键是控制温度,结合装置图归纳其措施有 、
和 。
(3)在滤液X中加入适量NaCl固体或无水乙醇均可析出过碳酸钠,原因是 。
(4)步骤③中选用无水乙醇洗涤产品的目的是 。
(5)测定样品中H2O2的质量分数的方法是:准确称取0.2000g过碳酸钠样品于250 mL 锥形瓶中,加50 mL 蒸馏水溶解,再加50 mL 2.000 mol·L-1 H2SO4 (H2SO4过量),用0.002000mol·L-1 KMnO4标准溶液滴定至终点时消耗30.00 mL。
①滴定前,滴定管需用KMnO4标准溶液润洗2~3次,润洗的操作方法是:关闭酸式滴定管活塞,向滴定管中注入少量KMnO4标准 。
②上述样品中H2O2的质量分数计算表达式为 (只列出算式,不作任何运算!H2O2的式量为34.00)。
(17分)
(1)平衡压强,便于溶液顺利滴下(2分,答到平衡压强或气压即给2分,其他合理答案酌情给分)
(2)冷水浴 磁力搅拌 (通过滴液漏斗)缓慢(或逐滴)滴加H2O2溶液(共6分,各2分。说明:磁力搅拌的目的是使反应产生的热量快速散去)
(3)降低产品(或过碳酸钠)的溶解性(度)(2分,意思到即给分)
(4)洗去水份(利于干燥)[1分],减少固体因溶解而损失[1分](共2分,其他合理答案酌情给分))
(5)①倾斜转动滴定管润洗整个滴定管内壁,(1分)然后打开活塞将润洗液从下端放出 (1分)[共2分,两个要点,一是倾斜转动,二是打开活塞将润洗液从下端放出,没有答到要点不给分。]
②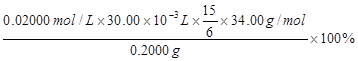 (3分)
(3分)
[参照广东高考评分意见,计算式完全正确,没带单位或不乘100%不扣分。如果计算出结果得0分,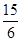 用2.5代替不扣分,其它数据如果进行了运算扣2分]
用2.5代替不扣分,其它数据如果进行了运算扣2分]
题目分析:(1)读图,由恒压滴液漏斗推断,支管的作用是平衡压强,便于溶液顺利滴下;(2)依题意,主反应是放热反应,温度过高导致H2O2分解,必须控制温度,减少H2O2的分解,图中用冷水浴、磁力搅拌器都能防止反应液温度过高;根据温度高低控制滴入双氧水的速度,也能控制反应液的温度;(3)过滤所得滤液是过碳酸钠的饱和溶液,加入适量NaCl或无水乙醇,都能降低其溶解度,导致滤液中析出过碳酸钠固体;(4)无水乙醇洗涤的目的是除去固体中混有的水分,有利于固体的干燥,同时还能减少过碳酸钠的溶解,降低损失;(5)①润洗酸式滴定管的操作方法是:关闭酸式滴定管活塞,向滴定管中注入少量KMnO4标准溶液,倾斜转动滴定管润洗整个滴定管内壁,然后打开活塞将润洗液从下端放出;由于n=c•V,则滴定时消耗了0.002000×30.00×10-3mol KMnO4;滴定反应为6KMnO4+5(2Na2CO3·3H2O2)+19H2SO4=3K2SO4+6MnSO4+10Na2SO4+10CO2↑+15O2↑+ 34H2O,根据各物质的系数之比等于物质的量之比,则被高锰酸钾氧化的过碳酸钠(2Na2CO3·3H2O2)为0.002000×30.00×10-3×5/6mol;由于2Na2CO3·3H2O2=2Na2CO3+3H2O2,根据各物质的系数之比等于物质的量之比,则样品中H2O2的物质的量为0.002000×30.00×10-3×5/6×3mol;由于m=n•M,则样品中H2O2的质量为0.002000×30.00×10-3×5/6×3×34.00g;由于样品质量为0.2000g,则样品中H2O2的质量分数计算表达式为0.002000×30.00×10-3×5/6×3×34.00/0.2000×100%。
