氧化亚铜是大型水面舰船防护涂层的重要原料。某小组进行如下研究,请填写下列空白。
实验1:氧化亚铜的制取氧化亚铜可用葡萄糖和新制氢氧化铜悬浊液反应制取。文献表明,条件控制不当时会有少量CuO生成。
(1)实验室制取氢氧化铜悬浊液的离子方程式为____________。
(2)实验室用此方法制取并获得少量氧化亚铜固体,需要的玻璃仪器有试管、酒精灯、烧杯____________和____________。
(3)若要探究该反应发生的最低温度,应选用的加热方式为____________。
实验2:测定氧化亚铜的纯度
方案1:称取实验1所得固体m g,采用如下装置进行实验。
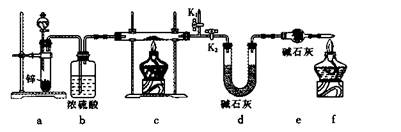
(4)装置a中所加的酸是____________(填化学式)。
(5)通过测出下列物理量,能达到实验目的的是____________。
A.反应前后装置a的质量
B.装置c充分反应后所得固体的质量
C.反应前后装置d的质量
D.反应前后装置e的质量(6)在氢气验纯后,点燃装置c中酒精灯之前需要对K1、K2进行的操作是 ____________
方案2:将实验l所得固体mg溶于足量稀硫酸,经过滤、洗涤、干燥后称出不溶物的质量(资料:Cu2O+2H+=Cu2++Cu+H2O)
(7)判断经干燥器干燥后的不溶物是否巳完全干燥的操作方法是__________________________________。
(8)若实验所得不溶物为ng,则该样品中氧化亚铜的质量分数为________________。
(1)Cu2++2OH—=Cu(OH)2↓(2分)
(2)漏斗、玻璃棒(各1分,共2分)
(3)水浴加热(2分)
(4)H2SO4(1分)
(5)BC(选对1个或全选都给2分)
(6)打开K2,关闭K1(2分)
(7)将不溶物再次干燥后称量,直至最后两次质量基本相同(或其他合理答案)(2分)
(8)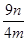 ×100% (或其他合理答案)(2分)
×100% (或其他合理答案)(2分)
题目分析:(1)实验室常用可溶性铜盐溶液与氢氧化钠反应制取氢氧化铜,反应式为Cu2++2OH—=Cu(OH)2↓;(2)葡萄糖与新制氢氧化铜混合直接加热需要试管、酒精灯,从液体中分离出Cu2O沉淀需要烧杯、漏斗、玻璃棒;(3)探究该反应发生的最低温度,可以选择水浴加热,需要温度计测量水浴的温度;(4)锌与非氧化性酸、难挥发性酸反应可以制取氢气,则a装置应加入稀H2SO4;(5)装置d增加的质量源自c中反应所生成水,由此可以计算出样品中氧元素的质量,c反应后所得固体的质量等于铜的质量,根据上述两种元素的质量可以测出氧化亚铜的纯度,故BC正确;(6)打开K2,关闭K1,通氢气一会儿后再加热c装置;(7)将不溶物再次干燥后称量,直至最后两次质量基本相同(或其他合理答案),说明不溶物是否巳完全干燥;(8)由m/M可知n(Cu)=n/64mol,由Cu2O+2H+=Cu2++Cu+H2O可知n(Cu2O)=n/64mol,由n•M可知m(Cu2O)=144n/64g=9n/4g,则样品中Cu2O的纯度为9n/4m×100%。
