A、B、C、D、E均为短周期元素,且原子序数逐渐增大.A、D最外层电子数相等且能形成离子化合物,A与B的质子数之和等于C的质子数,A+与 C2-的核外电子数之和等于D+离子的核外电子数,B 原子与 D+离子的核外电子数之和等于 E 原子的核外电子数.
(1)B的元素符号为______,E的原子结构示意图______;由A、C、E三种元素组成的化合物具有漂白性,其电子式为______.
(2)将少量的D2C2投入到Na2S溶液中,产生浑浊现象,则反应的离子方程式为______.
(3)A、B、C三种元素可组成多种化合物,请写出两种水溶液呈酸性的化合物,其中甲物质促进水的电离______,物质乙抑制水的电离______;室温下,若两溶液的pH都为4,则两溶液中水电离的氢离子浓度比为:甲:乙=______
(4)A与B化合形成10电子化合物丙,A与E化合形成18电子化合物丁;常温下,pH=11的丙溶液与pH=3的丁溶液等体积混合后溶液的pH______7(填“>”“<”“=”),溶液中离子浓度由大到小的顺序为______.
(5)A2与C2可构成燃烧电池,若电解质溶液为KOH溶液,该电池的负极反应为______.
A、B、C、D、E均为短周期元素,且原子序数逐渐增大.A、D最外层电子数相等,则为同族元素,且A、D能形成离子化合物,该族含有金属与非金属,为短周期元素,故为第ⅠA族,结合A、D原子序数可知,A为氢元素,D为钠元素;A+与 C2-的核外电子数之和等于D+离子的核外电子数,则C的质子数为10-2=8,故C为氧元素;A与B的质子数之和等于C的质子数,则B的质子数为8-1=7,故B为氮元素;B 原子与 D+离子的核外电子数之和等于 E 原子的核外电子数,则E的核外电子数为7+10=17,故E为氯元素.
故A为氢元素,B为氮元素;C为氧元素;D为钠元素;E为氯元素.
(1)由上述分析可知,B为N元素;E为氯元素,原子核外有17个电子,有3个电子层,最外层有7个电子,原子结构示意图为
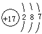
;由A、C、E三种元素组成的化合物具有漂白性,该化合物为HClO,分子中氧原子分别通过1对共用电子对与氢原子、氯原子连接,其电子式为
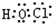
,
故答案为:N;
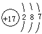
;
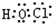
;
(2)将少量的Na2O2投入到Na2S溶液中,过氧化钠具有强氧化性,将硫离子氧化为S单质,产生浑浊现象,同时生成氢氧化钠,则反应的离子方程式为 2H2O+S2-+Na2O2═4OH-+S↓+2Na+,
故答案为:2H2O+S2-+Na2O2═4OH-+S↓+2Na+;
(3)A为氢元素,B为氮元素;C为氧元素;A、B、C三种元素可组成多种化合物,水溶液呈酸性的化合物,为酸或强酸弱碱盐,其中甲物质促进水的电离,甲为盐,则甲为NH4NO3,物质乙抑制水的电离,乙为酸,则乙为HNO3;室温下,若两溶液的pH都为4,NH4NO3溶液中氢离子为水电离氢离子,浓度为10-4mol/L,硝酸中水电离的氢离子浓度等于溶液中氢氧根离子浓度,浓度为
=10-10mol/L,则两溶液中水电离的氢离子浓度比为甲:乙=10-4mol/L:10-10mol/L=106,10-14 10-4
故答案为:NH4NO3;HNO3;106;
(4)A与B化合形成10电子化合物丙为NH3,A与E化合形成18电子化合物丁为HCl,常温下,pH=11的丙溶液中氢氧根离子浓度为10-3mol/L,pH=3的丁溶液中氢离子浓度为10-3mol/L,氨水是弱电解质,电离程度不大,等体积混合后溶液中氨水有剩余,为氯化铵与氨水混合液,剩余氨水浓度远大于氯化铵浓度,一水合氨的电离程度大于铵根离子的水解程度C(NH4+)>C(Cl-),C(OH-)>C(H+),所以溶液的pH>7,溶液中离子浓度由大到小的顺序为C(NH4+)>C(Cl-)>C(OH-)>C(H+),
故答案为:;C(NH4+)>C(Cl-)>C(OH-)>C(H+);
(5)H2与O2构成燃烧电池,若电解质溶液为KOH溶液,负极发生氧化反应,氢气在负极放电,在碱性条件下生成水,该电池的负极反应为 H2+2e-+2OH-=2H2O,
故答案为:H2+2e-+2OH-=2H2O.
