(14分)黄铜矿是工业炼铜的主要原料,主要成分为CuFeS2,含少量脉石。为测定该黄铜矿的纯度,某同学设计了如下实验:
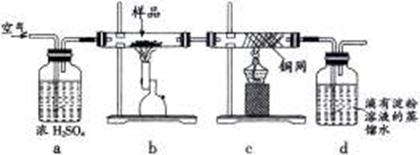
用电子天平称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准碘溶液20.00mL。请回答下列问题:
(1)将样品研细后再进行反应,其目的是 ;标准碘溶液应盛放在(填“碱式”或“酸式”) 滴定管中。
(2)装置a的作用是
(填序号)。
A.除去空气中的二氧化碳
B.除去空气中的水蒸气
C.有利于气体混合
D.有利于观察、控制空气流速(3)若去掉c装置,会使测定结果(填“偏低”、“偏高”或“无影响”) ,写出影响测定结果的化学方程式: 。
(4)上述反应结束后,仍需通一段时间的空气,其目的是 。
(5)通过计算可知,该黄铜矿的纯度为 。
(14分)
(1)使原料充分反应,加快反应速率(2分)酸式(2分)
(2)B D(2分)
(3)偏低(2分)  (2分)
(2分)
(4)使反应生成的气体全部进入d装置中,使测定结果精确(2分) (5)80%(2分)
题目分析:(1)将样品研细后再反应,即增大固体的表面积,目的是使原料充分反应、加快反应速率;标准液为I2溶液,具有氧化性,能氧化橡胶管,不能用碱式滴定管盛放,应选用酸式滴定管。
(2)装置a中的浓硫酸可易吸收空气中的水蒸气,同时根据冒出的气泡的速率来控制气体的通入量,故答案为:BD。
(3)去掉c装置,气体中二氧化硫在水溶液中会和氧气反应,反应的化学方程式为:2SO2+O2+H2O=2H2SO4,测定结果偏低。
(4)黄铜矿受热分解生成二氧化硫等一系列产物,分解完毕后仍然通入空气,可以将产生的二氧化硫全部排出去,进入d装置中,使结果精确。
(5)根据氧化还原反应中得失电子总数相等和S元素守恒可得到:2I2~2SO2~CuFeS2,消耗掉0.05mol/L标准碘溶液20.00mL时,即消耗的碘单质的量为:0.05mol/L×0.02L=0.0010mol,所以黄铜矿的质量是:0.5×0.0010mol×184g/mol×10=0.92g,所以其纯度是:0.92g÷1.15g×100%=80%。
