(1)甲元素位于元素周期表的第3周期ⅢA族,乙元素的原子结构示意图为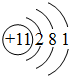
①写出甲、乙两种元素符号:甲______、乙______.
②甲元素原子核外有______个电子层.
③甲元素的金属性(即原子失电子的能力)比乙元素______(填“强”或“弱”).
(2)过氧化氢在适当条件下能发生分解反应:2H2O2=2H2O+O2↑
现进行如下实验探究:在甲、乙两支大小相同的试管中各装入3mL5%的过氧化氢溶液,再向其中的甲试管中加入少量MnO2粉末.请给合实验现象填写下列空白.
①实验目的:研究______(反应条件)对过氧化氢分解反应速率的影响.
②实验现象:______(选填“甲”或“乙”)试管中反应更剧烈,迅速放出无色气体.
③实验结论______.
(1)甲元素位于元素周期表的第3周期ⅢA族,则甲为Al元素,根据乙元素的原子结构示意图知,乙是Na元素,
①甲是Al、乙是Na元素,故答案为:Al;Na;
②元素所在的周期数与其电子层数数值相等,所以甲元素原子核外有3个电子层,故答案为:3;
③同一周期元素中,元素的金属性随着原子序数的增大而减弱,钠和铝属于同一周期,且钠的原子序数小于铝,所以铝的金属性小于钠,故答案为:弱;
(2)①根据实验的不同点确定实验目的,两个实验中不同点是:一个有催化剂、一个没有催化剂,所以其实验目的是研究催化剂对化学反应速率的影响,故答案为:催化剂;
②催化剂能加快反应速率,所以甲试管中反应较剧烈,故答案为:甲;
③根据实验现象知,有催化剂的反应速率比没有催化剂的反应速率快,由此得出催化剂能改变反应速率,故答案为:催化剂能改变反应速率.
