某研究性学习小组为测定NH3分子中氮、氢原子个数比,设计如下实验流程:

实验时,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。
下图A、B、C为该小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
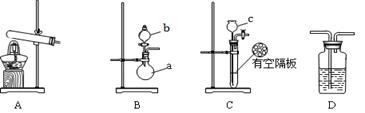
请回答下列问题:
(1)写出仪器的名称:a ,b 。
(2)硬质玻璃管中发生的反应方程式是 ,反应过程中硬质玻璃管的现象是 。
(3)请判断制取氨气可能用到的装置,在下表中你认为可行的装置中填写对应的实验药品(写出化学式)。
| 装置 | 实验药品 |
| A | |
| B | b: a: |
| C | c: 隔板: |
(4)实验时洗气瓶D中的浓硫酸表现 性;该小组实验测得:洗气前装置D的质量为m1g、洗气后装置D的质量为m2g、生成的氮气在标准状况下的体积为V L。根据该小组计算NH3分子中氮、氢的原子个数比的表达式,请预计该结果与理论值相比, 。
A.在实验误差范围内数值接近理论值 B.数值偏高 C.数值偏低
(1)圆底烧瓶(2分),分液漏斗(2分)
(2)2NH3+3CuO 3Cu+N2+3H2O(2分),黑色固体变成红色(2分)
3Cu+N2+3H2O(2分),黑色固体变成红色(2分)
(3)(每种可行装置各2分,共4分)
| 装置 | 实验药品 |
| A | NH4Cl、Ca(OH)2 |
| B | b:NH3·H2O(aq) a:CaO或 NaOH或CaO、NaOH |
(4)吸水和酸(2分), C (2分)
题目分析:(1)从图中可知仪器a的名称为:圆底烧瓶,b为分液漏斗;
(2)根据试验流程制取得到的氨气干燥后通入了硬质玻璃管中,并在加热下与CuO发生了反应,由于CuO有氧化性,氨气有还原性,所以二者发生氧化还原反应,方程式为2NH3+3CuO 3Cu+N2+3H2O,由此可知有铜单质生成,所以可观察到现象是黑色固体变成了红色物质。
3Cu+N2+3H2O,由此可知有铜单质生成,所以可观察到现象是黑色固体变成了红色物质。
(3)图中A、B、C为该小组制取氨气时可能用到的装置,所以根据氨气制备的原理,可以是固-固加热型,也可以是固-液不加热型,所以根据装置类型可以选用相应实验药品为:
| 装置 | 实验药品 |
| A | NH4Cl、Ca(OH)2 |
| B | b:NH3·H2O(aq) a:CaO或 NaOH或CaO、NaOH |
(4)由于洗气瓶D中的浓硫酸不但吸收了反应生成的水,还吸收了过量的氨气,所以表现的是浓硫酸的吸水性和酸性;正因为浓硫酸吸收了水和氨气,所以根据该计算公式,会使计算的H的量偏高,则N:H反而变小,小于理论值。
