有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,已知A和B原子有相同的电子层数,且A的最外层电子数是次外层电子数的两倍,C是该周期中原子半径最大的元素,C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的固态化合物C2B2,E与D相邻. 试根据以上叙述回答:
(1)元素名称 C______ E______
(2)写出物质的电子式 AB2______ C2B______
(3)用电子式表示CE的形成过程______
(4)D、E的气态氢化物的稳定性______>______(填化学式)
(5)写出C、E两种元素的最高价氧化物对应的水化物间反应的离子方程式______.
A和B原子有相同的电子层数,则二者位于相同周期,且A的最外层电子数是次外层电子数的两倍,则A应为C元素,C是该周期中原子半径最大的元素,应为Na元素,C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的固态化合物C2B2,则该化合物为Na2O2,为黄色固体,则B为O元素,D为S元素,E与D相邻,且有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,则E为Cl元素,
(1)由以上分析可知:C为Na元素,E为Cl元素,故答案为:Na;Cl;
(2)AB2为CO2,为共价化合物,电子式为
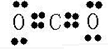
,C2B为Na2O,为离子化合物,电子式为
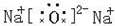
,故答案为:
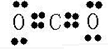
;
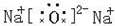
;
(3)CE为NaCl,用电子式表示形成过程为:
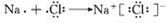
,
故答案为:
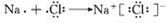
;
(4)D、E的气态氢化物的分别为H2S、HCl,元素的非金属性越强,则对应的氢化物越稳定,则有HCl>H2S,
故答案为:HCl;H2S;
(5)C、E两种元素的最高价氧化物对应的水化物分别为NaOH和HClO4,二者反应的离子方程式为:OH-+H+=H2O,
故答案为:OH-+H+=H2O.
