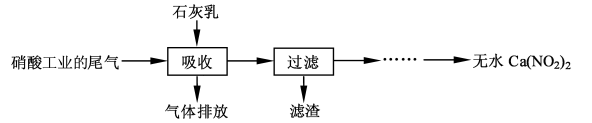
(12 分)利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:
(1)一定条件下,NO 与NO2存在下列反应:NO(g)+NO2(g) N2O3(g),其平衡常数表达式为K = 。
N2O3(g),其平衡常数表达式为K = 。
(2)上述工艺中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋), 其目的是 ;滤渣可循环使用,滤渣的主要成分是 (填化学式)。
(3)该工艺需控制NO 和NO2物质的量之比接近1 颐1。若n(NO):n(NO2)>1 颐1,则会导致 ;若n(NO):n(NO2)<1 颐1,则会导致 。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为 。
(1) c(N2O3)/c(NO)·c(NO2) (2)使尾气中的NO、NO2被充分吸收 Ca(OH)2
(3)排放气体中NO 含量升高 产品Ca(NO2)2中Ca(NO3)2含量升高
(4)3NO2 -+2H+ =NO3- +2NO↑+H2O
(1)考查平衡常数概念,将反应物生成物浓度代入平衡常数的表达式中。
(2)反应中逆流操作能使反应物之间充分接触,反充分应能提高原料的利用率;反应消耗N2O3,促进气体转化的平衡正向反应,最后完全吸收,过滤得到的残渣是过量的氢氧化钙。
(3)若NO量较多,NO不能被碱吸收,排放的气体中会含有较多的NO,若NO2的量较多,NO2会与碱反应生成亚硝酸钙和硝酸钙的混合物,即亚硝酸钙中含硝酸钙。
(4)根据氧化还原反应规则,反应生成NO时元素化合价降低,则必有元素化合价升高,经分析只能是N元素化合价升高,即生成硝酸钙。
【考点定位】工业制取Ca(NO2)2的流程分析